Строительные работы в Севастополе
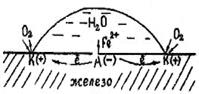
Под электрохимической коррозией подразумевают процесс взаимодействия металлов с электролитами в виде водных растворов, реже с неводными электролитами, например, с некоторыми органическими электропроводными соединениями или безводными расплавами солей при повышенных температурах. Делится на электрокоррозию и гальванокоррозию. Из указанных разновидностей рассмотрим лишь гальванокоррозию. 2.2.1 Электрохимическая гальванокоррозия. Электрохимическая коррозия – наиболее распространенный вид коррозии металлов. Примером коррозионных процессов электрохимического характера является разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере под адсорбированными пленками влаги, в технических растворах. Растворенный кислород и ионы водорода – важнейшие окислители, вызывающие электрохимическую коррозию металлов. Рассмотрим схему этого процесса. Сложность его заключается в том, что на одной и той же поверхности происходят одновременно два процесса, противоположные по своему химическому смыслу: окисление металла и восстановление окислителя. Оба процесса должны протекать сопряженно, чтобы сохранялось равенство числа электронов, отдаваемых металлом и присоединяющихся к окислителю в единицу времени. Только в этом случае может наступить стационарное состояние. Итак, процессы электрохимической коррозии протекают по законам электрохимической кинетики, когда общая реакция взаимодействия может быть разделена на следующие, в значительной степени самостоятельные, электродные процессы: – анодный процесс – переход металла в раствор в виде ионов (в водных растворах, обычно гидратированных) с оставлением эквивалентного количества электронов в металле: Ме 0 – nē → Ме n+ – катодный процесс – ассимиляция появившихся в металле избыточных электронов деполяризаторами. Различают коррозию с водородной и кислородной (или окислительной) деполяризацией. При наличии в растворе газообразного кислорода и невозможностью протекания процесса коррозии с водородной деполяризацией основную роль деполяризатора исполняет кислород. Коррозионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяризацией. Это наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха. Общая схема кислородной деполяризации сводится к восстановлению молекулярного кислорода до иона гидроокисла: O + 4ē +2h3O → 4OH—. В случае водородной деполяризации на катоде протекает процесс восстановления ионов водорода, находящихся в среде: 2Н++ 2ē + → Н2. Выбор того или иного способа определяется его эффективностью, а также экономической целесообразностью. 2.3.1 Легирование металла – эффективный (хотя обычно дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава обычно вводят компоненты, вызывающие пассивирование металла. В качестве таких компонентов применяются хром, никель, вольфрам и др. Основное средство защиты металлов от газовой коррозии – легирование такими компонентами, которые улучшают свойства защитных пленок, образующихся при окислении металла. Для стали такими элементами являются хром, алюминий, кремний. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов. 2.3.2 Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Выбор вида покрытия зависит от условий, в которых используется металл. Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. В зависимости от величины электродного потенциала защищаемого металла и покрытия, различают катодные и анодные покрытия. Катодное покрытие – металл покрытия менее активен, чем защищаемый металл. Например, олово хорошо покрывает железо и достаточно стойко против действия разбавленных растворов кислот. В случае механического повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову; анодом здесь является железо, а катодом олово. В этом случае разрушается железо, а олово остается без изменений (рисунок 5). Анодное покрытие – покрытие более активным металлом. Например, покрытие железа цинком (рисунок 4). При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом, а анодом – цинк. Электроны переходят от цинка к железу, цинк разрушается, а железо остается защищенным до тех пор, пока не разрушится весь цинк. На основании вышеизложенного можно сделать вывод о том, что более надежным является анодное покрытие. а)б) 1 – раствор; 2 – покрытие; 3 – основной материал; 4 – пора Рисунок 4 – Схема коррозии металла в кислом растворе при нарушении анодного а) и катодного б) покрытия К ряду покрытий, получаемых химической обработкой металла, относятся защитные покрытия, образующиеся непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных пленок носит в технике общее название оксидирование. Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий могут быть неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной. 2.3.3 Электрохимические методы защиты. Методы электрохимической защиты основаны на изменении потенциала защищаемого металла и не связаны с изоляцией металла от коррозионной среды. К ним относятся катодная защита, называемая также электрозащитой, и протекторная (или анодная) защита. Катодная защита заключается в том, что защищаемая конструкция А (рисунок 5), находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду внешнего источника электричества В. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла Б (рельс, балка), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается. Протекторная защита отличается от катодной защиты тем, что для ее осуществления используется специальный анод – протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор Б (рисунок 6) соединяют с защищаемой конструкцией А проводником электрического тока В. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя от разрушения защищаемую конструкцию. Рисунок 5 – Схема катодной Рисунок 6 – Схема анодной защиты (протекторной) защиты 2.3.4 Изменение свойств коррозионной среды. Изменение свойств коррозионной среды пригодно для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Один из методов состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация). В качестве примера можно привести освобождение воды, идущей на питание паровых котлов, от растворенного в ней кислорода, что достигается, например, при фильтровании воды через слой железных стружек. Для замедления коррозии металлических изделий в агрессивную среду вводят вещества, называемые ингибиторами (или замедлителями) коррозии. Это имеет большое значение в тех случаях, когда металл необходимо защищать от разъедания кислотами. В зависимости от вида коррозии, природы металла и раствора применяются различные ингибиторы, действие которых специфично. 2.3.5 Создание рациональных конструкций. Выбор материалов и их сочетаний для данной машины, конечно, диктуется технической и экономической целесообразностью, но должен обеспечивать ее коррозионную устойчивость. Конструктор должен предусмотреть рациональные формы машины, допускающие быструю очистку от грязи; машина не должна иметь мест скопления влаги, которая является возбудителем коррозии. studfiles.net Коррозия металлов . Коррозия- разрушение металла в результате его физико- химичекского взаимодействия с окружающей средой Процесс коррозии – это растворение металла в естественных условиях при взаимодействии с окружающей средой Первопричиной коррозии металлов, в том числе и электрохимической коррозии, является их термодинамическая неустойчивость. При взаимодействии с электролитами или с газами, металлы самопроизвольно растворяются, переходя в более устойчивое окисленное (ионное) состояние. Большой теоретический и практический интерес представляет механизм этого саморастворения металлов, т.е. механизм коррозионного процесса, его основные закономерности, скорость протекания процесса и характер коррозионного разрушения. Самопроизвольный переход металлов в окисленное (ионное) состояние при взаимодействии с другими веществами может протекать по 2м различным механизмам: 1) химическому; 2) электрохимическому. По условиям протекания процесса делится на: 1.Газовая коррозия- отсутствие влаги на поверхности металла при высоких температурах 2.Коррозия в неэлектролитах –бензин керосин, органические жидкости 3, Коррозия в электролитах . 4. Коррозия в естественных условиях-атмосферная, морская, подземная 5. Коррозия под напряжением ( одновременное воздействие коррозионной среды и механических поврежлений 6. Фреттинг-(одновременное воздействие коррозтонной среды и трения). 7 Кавитация-(при ударном воздействии коррозионной среды) Скорость коррозии выражают следующими способами: 1 Массовый – потеря массы за единицу времени к единице площади испытуемого образца 2. Глубинный-уменьшение толщины в единицу времени 3. Скорость электрохимической коррозии можно выразить величиной тока, приходящейся на единицу площади металла. Химический механизм: химическая реакция проходит на одном и том же участке поверхности в одну стадию, и ее скорость не зависит от потенциала, при этом металл отдает окислителю валентные электроны, вступая с ним в химическое соединение. Этот механизм имеет место в газовой фазе, но помимо газовой фазы может происходить в электролите. 1) растворение железа, Cr в 0,1 N h3SO4 (Л.М. Колотыркин и Г.М. Флорианович) Ме + nН2О = Меn+ + nOH- + h3 2) разложение амальгам щелочных металлов растворами с высоким рН (В.Н.Коршунов, В.А. Иофа) Me(Hg) + h3O = Me+ + h3 + OH- + Hg 3) растворение Al в 50% СНОСООН (Жук Н.П.) 4Al + 3O2 + 12H+ = 4Al3+ + 6h3O Обязательным условием реализации электрохимического вида коррозии является наличие электропроводящей среды-растворов кислот, щелочей или солей. При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекает не в одном акте и их скорости зависят от электродного потенциала. Процесс электрохимической коррозии представляет совокупность двух сопряжено протекающих реакций: 1. анодное окисление металла Ме – nе → Меn+ 2. катодное восстановление окислителя (Ох) Ох + nе → Red где Ох – окислитель, деполяризатор, присоединяющий к себе nе электронов, которые освободились в результате анодной реакции (ионизации металлов). Возможность подразделения процесса растворения металлов в электролитах на два сопряженных процесса – анодный и катодный – облегчает в большинстве случаев его протекание по сравнению с химическим воздействием. При электрохимическом взаимодействии окислитель играет роль деполяризатора, отнимающего валентные электроны металла и обеспечивающие переход металла в ионное состояние, но не вступает с ним при этом в химическое соединение (вторичные процессы и продукты коррозии при электрохимическом механизме коррозии могут иметь место), но они не обязательны. Особенности электрохимического процесса коррозии. 1. Разделение его на 2 одновременно протекающих электродных процесса: анодный и катодный; 2. Зависимость этих 2х электрохимических процессов, а следовательно, и скорости коррозии от величины электродного потенциала в соответствии с законами кинетики; 3. Возможность локализации электродных процессов на различных участках поверхности металла, где их протекание облегчено. Электрохимическая коррозия металла протекает в средах, имеющих ионную проводимость через 2 реакции: анодное окисление металла и катодное восстановление окислителя. Окислителями при коррозии служат молекулы кислорода О2, хлора Cl, ионы Но, Fe3+, NO33+ и др. Наиболее часто при коррозии наблюдается восстановление кислорода. В нейтральной или щелочной среде О2+ 2Н2О + 4е → 4ОН- В кислой среде О2 + 4Н2О + 4е → 2Н2О и выделение водорода 2Н+ + 2е → Н2 Коррозия с участием кислорода называется коррозией с поглощением кислорода (коррозия с кислородной деполяризацией). Коррозия с участием ионов водорода называется коррозией с выделением водорода (или коррозия с водородной деполяризацией). Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите. Электролитами могут быть растворы солей, кислот, оснований, морская вода, почвенная вода, вода атмосферы, содержащая СО2, SO2, О2 другие газы. Кроме электрохимических реакций, при коррозии протекают вторичные химические реакции, например, взаимодействие ионов металла с гидроксид ионами, концентрация которых повышается в результате катодных реакций. Mn+ + nOH = M(OH)n Коррозия с кислородной деполяризацией представлена уравнениями: Me – ne → Men+ анодный процесс О2 + 2Н2О + 4е → 4ОН- катодный процесс Коррозия с водородной деполяризацией может быть представлена уравнениями: Me – ne → Men+ анодный процесс 2Н+ + 2е → Н2 катодный процесс Возникновение коррозии связано с образованием коррозионных гальванических элементов. Электрохимическая коррозия протекает через анодные и катодные процессы с движением электронов и ионов (электрический ток), т.е. аналогично процессам в гальваническом элементе, поэтому такая коррозия получила название электрохимической коррозии. 1ая теория коррозии, объясняющая разрушение металла при взаимодействии с окружающей средой, теория швейцарского физика (де-ля-Рив) Рив-теория локальных элементов. У любого металла есть примеси. Между основным металлом и примесью возникает локальный гальванический элемент, при котором основа металла разрушается, а на примеси идет процесс восстановления. На аноде протекает реакция окисления железа анодная Fe – 2e → Fe2+ На катоде происходит восстановление водорода. катодная 2Н+ + 2у → 2Н20 → Н2 Рис. Схема коррозионного гальванического элемента, где анод и катод соприкасаются друг с другом, т.е. коррозионный элемент является короткозамкнутым. Происходит перетекание электронов от более отрицательного электрода (анода) к менее отрицательному 9или более положительному электроду) катоду [Весьма существенным для протекания является решение вопроса, какие из электродов являются катодами, а какие анодами]. Это перетекание электронов выравнивает значения потенциалов замкнутых электродов и если бы не было анодных и катодных процессов, то потенциалы электродов сравнялись и наступила полная поляризация. Но она в действительности не происходит, т.к. анодные и катодные процессы продолжаются, препятствуя наступлению полной поляризации вследствие протекания электронов с анода на катод, т.е. действуя деполяризующее, т.е. уменьшая полную поляризацию. Рассмотрим работу обычного поляризационного гальванического элемента, состоящего из Fe анода, угольного катода, погруженный в раствор h3SO4- На аноде реакция окисления железа Fe – 2e → Fe2+ На катоде 2Н+ + 2е → Н2 Электроны по пути во внешней цепи от анода (железа) к катоду (водородному электроду на угле) совершают полезную работу. В гальваническом элементе и в коррозионном гальваническом элементе протекают одни и те же процессы, за исключением тока во внешней цепи, поскольку последний в коррозионном элементе отсутствует. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия передается не в виде работы, а лишь в виде теплоты. studfiles.net Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока. При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов: Анодного – металл в виде ионов переходит в раствор. Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель). Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами. Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией. Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов: 1)Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители. 2)Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах. 3)Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители. 4)Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей. Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии: Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде. Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии. Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода: Катодом является та поверхность, где больше приток кислорода. Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее. Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.• Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ. Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, h3S и др., способствующие коррозии металла. Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов. studfiles.net Электрохимическая коррозия – это наиболее распространенный тип нарушения целостности металлической структуры. При этом не обязательно погружение детали в электролит. Часто бывает достаточно наличия тонкой пленки на поверхности материала. Электрохимическая коррозия металлов происходит, в большей степени, в результате повсеместного применения технической и бытовой соли (хлорид калия и натрия). Чаще всего эти вещества используют в зимний период для быстрого устранения льда и снега с улиц городов. Больше всего, как показывает практика, ущерба таким образом наносится подземным коммуникациям и наземному транспорту. Электрохимическая коррозия наблюдается на деталях машин, конструкций, приборов, находящихся в условиях почвы, грунта, воды (морской или речной), атмосферы, в растворах технического назначения, под воздействием смазочных, охлаждающих продуктов. Разрушение могут спровоцировать блуждающие токи, которые возникают при утечке части тока из электрической цепи в почву или воду, а оттуда – в элементы конструкций. Там, где происходит обратный выход (из металлов в почву или воду) отмечается разрушение деталей – электрохимическая коррозия. Чаще всего блуждающие токи формируются в местах, где движется наземный транспорт (трамваи, железнодорожные локомотивы на электрической тяге). При этом, как показывают исследования, 1 Ампер за год способен растворить 33,4 кг свинца, 10,7 кг цинка и 9,1 кг железа. Часто в развитии разрушения участвует несколько факторов. Электрохимическая коррозия представляет собой особый процесс. Сплав (или самостоятельный материал) утрачивает часть имеющихся атомов. Они (атомы) переходят в виде ионов в электролитический раствор. Вместо утраченных металлом частиц появляются электроны, которые заряжают материал отрицательным зарядом. При этом электролит обладает зарядом положительным. Таким образом, электрохимическая коррозия формирует гальваническую пару. Окислительно-восстановительным реакциям в большей степени способствует неоднородность в химической структуре материала. Провоцирующими факторами в формировании анодов и катодов являются и участки остаточной деформации, отсутствие однородности в покрывающих металл защитных пленках. Пронаблюдать разрушение деталей можно и в домашних условиях. Для этого потребуются три гвоздя, три стакана с солевым раствором (пищевая соль, растворенная в воде), небольшой кусочек цинка, медная проволока (изоляцию следует устранить). Первый гвоздь опускается в стакан с солевой смесью. Ко второму следует прикрутить проволоку и также поместить в раствор (во второй стакан). Третий гвоздь опускается в третью емкость. Оставить на двое-трое суток. По истечении этого периода на всех трех гвоздях будет отмечаться ржавчина. Однако в самом плохом состоянии будет гвоздь с проволокой, в лучшем – с цинком. Такая разница связана с различной способностью металлов отдавать электроны. Для защиты материала применяют метод изменения его потенциала. Следует отметить, что методика не связана с изоляцией. В качестве защиты применяют катодный (анодный) метод. При этом защищаемую конструкцию, находящуюся в неблагоприятной (например, в почвенной) среде, присоединяют к катоду (заряженному отрицательно электроду) электрического источника. Таким образом, деталь становится катодом. В эту же среду помещают и старую деталь, присоединяя ее к аноду от внешнего источника. Коррозийный процесс приводит к разрушению старого металла, который становится анодом. Существует также и протекторный тип защиты. В отличие от описанного выше, этот вариант предусматривает применение особого анода – протектора. В его качестве используют более активный, нежели у защищаемой конструкции, металл. В процессе коррозийного разрушения протектор выполняет задачу анода (положительного электрода) и, разрушаясь, предохраняет от нарушения целостности в охраняемой детали. fb.ru Коррозия и методы защиты от нее Корро́зия, ржавление, ржа — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: Гидроксид железа и является тем, что называют ржавчиной. В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозии полимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков. Классификация видов коррозии Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии. По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов: · газовая коррозия; · атмосферная коррозия; · коррозия в неэлектролитах; · коррозия в электролитах; · подземная коррозия; · биокоррозия; · коррозия под воздействием блуждающих токов. По условиям протекания коррозионного процесса различаются следующие виды: · контактная коррозия; · щелевая коррозия; · коррозия при неполном погружении; · коррозия при полном погружении; · коррозия при переменном погружении; · коррозия при трении; · межкристаллитная коррозия; · коррозия под напряжением. По характеру разрушения: · сплошная коррозия, охватывающая всю поверхность: o равномерная; o неравномерная; o избирательная; · локальная (местная) коррозия, охватывающая отдельные участки: o пятнами; o язвенная; o точечная; o сквозная; o межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях). Главная классификация производится по механизму протекания процесса. Различают два вида: · химическую коррозию; · электрохимическую коррозию. Коррозия неметаллических материалов По мере ужесточения условий эксплуатации (повышение температуры, механических напряжений, агрессивности среды и др.) и неметаллические материалы подвержены действию среды. В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин». При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными. Коррозия металлов Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов. Типы коррозии Различают 4 основных вида коррозии: электрохимическая коррозия, водородная, кислородная коррозия и химическая. 1. a) В некоторых металлах (Zn) катионы легко переходят в раствор; пластины заряжаются отрицательно, а раствор положительно. б) Катионы в растворе легко теряют гидратные оболочки и адсорбируются на поверхность металлов: металл +, раствор -. Вывод: Металлы (рис. а) являются анодами по отношению к водородному электроду, а (рис. б) катодами. Потенциалы газовых электродовГазовые электроды могут быть обратимыми относительно анионов (кислородный) или относительно катионов (водородный). Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы, т.е. быть инертным, а также обладать хорошей адсорбционной способностью, так как в электродном процессе участвуют адсорбированный газ и его ионы в растворе. Всем этим требованиям удовлетворяют платина, покрытая электролитическим способом платиновой чернью, и металлы платиновой группы, поэтому они чаще всего используются при создании газовых электродов. Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то потенциалы этих электродов зависят от парциальных давлений газов. Потенциал водородного электрода зависит от РН. Кислородный электрод: Потенциал кислородного электрода так же изменяется при изменении Электрохимическая коррозия - наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением внутри системы электрического тока. Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д. Причиной электрохимической коррозии является образование на поверхности металла большого количества микрогальванических пар, которые возникают по следующим причинам: 1. Наличие примесей металлов или других веществ, отличающихся по активности от основного металла. 2. Структурная неоднородность поверхности металла, что определяет наличие участков с разной активностью. 3. Неравномерность распределения деформаций в металле после термической и механической обработки и др. При электрохимической коррозии на поверхности металла одновременно протекают два процесса: анодный - окисление металла: и катодный - восстановление ионов водорода в кислой среде: или молекул кислорода, растворенного в воде, в случае атмосферной коррозии: Не следует путать электрохимическую коррозию с электрохимической коррозией однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается. Коррозионный элемент При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки. Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах. Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля): , где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия - солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева. Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах: Правый электрод: Левый электрод: Общая реакция: Для защиты железных конструкций от коррозии наиболее часто применяют металлическое покрытие из цинка (оцинкованное железо, жесть) или олова (луженое железо, белая жесть). В первом случае цинк является более активным восстановителем, чем железо, так как Ре Ге2+ = = -0,440 В. Поэтому при нарушении покрытия в коррозионных микрогальванических элементах цинк будет анодом и разрушаться, а железо катодом — местом, для осуществления процессов восстановления окислителей среды. Для описания процессов в этой системе на рис. 38.7 следует слева взять более активный металл — цинк (вместо железа), а справа — менее активный — железо (вместо меди) и заменить ионы железа в среде на ионы цинка. Поскольку в данном процессе цинк является анодом, то цинковое покрытие железа называется анодным покрытием. Таким образом, электрохимическая коррозия металлов — это результат деятельности микрогальванических элементов на их поверхности. Микрогальваническими элементами может быть объяснена характерная особенность кинетики взаимодействия металлов с кислотами — в течение довольно длительного начального периода скорость растворения металла и выделения водорода возрастает. Это связано с постепенным накоплением на реакционной поверхности тех включений, которые в начале реакции находились не на поверхности. Деполяризация Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита. В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим пример коррозии Zn/Fe В данном случае цинк будет анодом (Zn=-0,76), а железо – катодом (Fe= –0,44). На анодном участке будет происходить: – окисление – восстановление Схема возникающего гальванического элемента выглядит следующим образом: нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде: – окисление – восстановление Схема короткозамкнутого гальванического элемента: У поверхности металла в электролите протекают следующие реакции: Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции. megaobuchalka.ru Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии. В простейшем случае коррозии металлов с образованием их растворимых продуктов (т.е. ионов Меn+) коррозионные процессы принято называть процессами растворения металлов. Образование ионов металла из его атомов, например, в кислом растворе электролита можно представить совокупностью реакций в которой электроны освобождаются, и в которой электроны, освободившиеся в реакции (4.IV), присоединяются к ионам водорода. В результате на металле одновременно протекают две реакции — анодная (4.IV) и катодная (4.V). Перенос электронов осуществляется на поверхности металла, а перемещение ионов — в электролите При протекании электрохимического процесса анодный и катодный потенциалы Еа и Ек выравниваются и принимают значение потенциала ЕСТ. Этот потенциал называют потенциалом свободной коррозии. При ЕСТ соблюдается равенство катодного и анодного токов, т.е. ia = iк = iкор где iкор — скорость коррозии или саморастворения металла. Скорость электрохимической коррозии металлов в агрессивных средах ограничивается явлением поляризации. Причина поляризации электрода, возникновение перенапряжения состоит в том, что при протекании на электроде электрохимической реакции (окисления или восстановления) могут возникнуть того или иного рода затруднения. Поскольку в стационарных условиях скорость процесса определяется самой медленной стадией, то для ее ускорения требуется определенные энергетические затраты, вызывающие перенапряжение. Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией. Коррозия металлов с водородной деполяризацией имеет место: , т.е. в растворах кислот, например, кислотное растворение железа, цинка и других металлов; при достаточно отрицательных значениях потенциала ионизации металла, например, коррозия магния в воде или растворах солей. На практике с такими явлениями сталкиваются при хранении и перевозке кислот, при кислотном травлении металлов, при получении кислот на стадии абсорбции. Главными причинами катодной поляризации является замедленная стадия электрохимического разряда или концентрационная поляризация по молекулярному водороду, связанная с отводом газообразного продукта. являются большим и самостоятельным вопросом, в изучение и развитие которого значительный вклад внесли работы ученых научной школы академика А.Н. Фрумкина. Эти работы широко освещаются в учебниках по электрохимии. Мы приведем только краткие, основные сведения. зависимость изменения потенциала от плотности тока является линейной. равен 118 мВ, что отвечает механизму замедленной стадии разряда с переносом одного электрона, хотя не исключены и другие механизмы. Константа а в уравнении Тафеля (4.22) зависит от материала катода или материала инородных катодных включений в составе сплавов и численно определяется как величина перенапряжения при плотности тока, равной 1 А/см2. Наиболее высокое перенапряжение наблюдается на свинце, ртути, кадмии, цинке. Поляризация вследствие замедленной диффузии молекулярного водорода носит название газовой концентрационной поляризации. Она сопровождает процесс водородной деполяризации, начиная с самых низких плотностей катодного тока. имеет вид, изображенный на рис. 4.6 (участки АВ и ВС). . Давление внутри металла увеличивается и происходит разрыв сплошности металла. Таким образом, коррозия металлов с водородной деполяризацией характеризуется: большой зависимостью скорости коррозии металла от рН раствора; большой зависимостью коррозионной стойкости сплавов от их природы и содержания в них катодных примесей; увеличением скорости коррозии во времени, что связано с ростом посторонних примесей на поверхности металла в результате его расторения; возможностью появления водородной хрупкости металлов. .14. Электрохимическая коррозия металлов. Общая характеристика электрохимического коррозионного процесса и явление поляризации. Коррозионный процесс с кислородной деполяризацией При наличии в растворе газообразного кислорода и не возможностью протекания процесса кор-розии с водородной деполяризацией основную роль деполяризатора исполняет кислород. кор-розионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяриза-цией. Это наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха. Общая схема кислородной деполяризации сводится к восстановлению молекулярного кислорода до иона гидроокисла: O + 4e +2HO -> 4OH Термодинамические возможности кислородной деполяризации. Протекание процесса коррозии металла с кислородной деполяризацией согласно уравнения возможно при условии: где ( ) - обратимый потенциал кислородного электрода, равный: где ( ) - стандартный потенциал кислородного электрода, т.е. (обратимый) потенциал кислород- ного электрода при 25 С. a =1 P =101 Па (1 атм) Схема кислородной деполяризации. Каждый процесс с кислородной деполяризацией включает следующие последовательные ста- дии: 1) Растворение кислорода воздуха в растворе электролита. 2) Транспортировка растворенного кислорода в растворе электролита (за счет диффузии или перемешивания) к слою Прандтля. 3) Перенос кислорода в части слоя Прандтля ( ) в результате движения электролита. 4) Перенос кислорода в диффузионном слое электролита толщиной или в пленке продуктов коррозии металла к катодным участкам поверхности. 5) Ионизация кислорода: а) в нейтральных и щелочных растворах б) в кислых растворах 6) Диффузионный или конвектный перенос ионов ОН от катодных участков поверхности корро- дирующего металла в глубь электролита. В реальных условиях коррозии металла наиболее затрудненными стадиями процесса являют- ся: а) реакция ионизации кислорода на катоде. Возникающую при этом поляризацию называют перенапряжением кислорода. Говорят, что процесс идет с кинетическим контролем. б) Диффузия кислорода к катоду, либо перенапряжение диффузии. В этом случае, говорят, что процесс идет с диффузионным контролем. studfiles.net Электрохимическая коррозия металла может проявиться в тех случаях, когда имеет место граница раздела фаз металл-электролит. Факт проявления коррозии не зависит от природы электролита, будь это сверхчистая вода или расплавленная соль. Не имеет существенного значения и количество электролита - в предельном случае это может быть пленка влаги толщиной в несколько десятков миллимикрон. Схема процесса коррозии.Анодный процесс при коррозии всегда заключается в ионизации металла. Металл переходит в раствор в виде гидратированных ионов, при этом в металле остается соответствующее число электронов. Примерами анодных реакций могут быть: Fe - 2ē = Fe2+ - окисление железа Al - 3ē = Al3+- окисление алюминия В общей форме реакция выглядит так: Me – nē = Men+, где Me - металл. Катодный процесс - поглощение появившихся в металле избыточных электронов с помощью так называемых деполяризаторов, которыми могут являться атомы, молекулы, ионы раствора, подвергающиеся восстановлению на всей поверхности металла или отдельных ее участках. Примерами катодных реакций могут быть следующие: 2Н+ + 2ē → 2Н → Н2 - восстановление ионов водорода в кислой среде. О2 + 4Н+ + 4ē → 2Н2О - восстановление растворенного кислорода в кислой среде. О2+2Н2О + 4ē → 4ОН-- восстановление растворенного кислорода в нейтральной или щелочной среде. В общей форме уравнение катодной реакции выглядит так: D + ē → D, где D – деполяризатор. Поляризация и ее виды. Коррозия металлов с кислородной и водородной деполяризацией.При прохождении через электрод электрического тока извне происходит смещение его потенциала. Численная величина изменения потенциала вследствие прохождения тока называется поляризацией. Причина возникновения поляризации состоит в том, что переход зарядов из металла в раствор и перемещение ионов в электролите встречают определенное сопротивление. В зависимости от вызывающих его факторов различают три вида по- ляризации: концентрационную, активационную и оммическую. Причиной концентрационной поляризации является разность концентраций ионов в приэлектродном пространстве, следствием чего является изменение потенциала электрода. Возникновение активационной поляризации обусловлено сопротивлением, возникающим во время катодной реакции присоединения электронов деполяризатором или торможением при переходе катионов из металлической решетки в раствор. В электрохимии эти процессы называют стадиями, считается, что самая замедленная стадия определяет скорость процесса. Преодоление такого сопротивления требует добавочной активационной энергии, поэтому и поляризация называется активационной. Омической поляризацией называется падение потенциала JR, вызываемое электрическим сопротивлением слоя электролита вблизи электрода или слоя продуктов реакции, а также обоих этих слоев одновременно. В зависимости от направления сдвига потенциала электрода при прохождении постоянного тока различает анодную и катодную поляризации. Анодной поляризацией называется сдвиг потенциала в положительную сторону, катодной поляризацией - его перемещение в отрицательную сторону. На практике всегда стремятся к увеличению поляризации в коррозионном элементе. Благодаря поляризации металлов скорость коррозии уменьшается в сотни, а то и в тысячи раз. Явление, противодействующее поляризации электрода, принято называть деполяризацией. Деполяризация (анодная и катодная) ускоряет процесс коррозии. Среди большого количества реакций катодной поляризации в коррозионных процессах наибольшее значение имеют реакции, в которых в роли, деполяризатора выступает кислород (кислородная деполяризация) или ионы водорода: водородная поляризация). С водородной деполяризацией протекает коррозия всех металлов, стоящих левее водорода в ряду напряжений, в кислых средах. В нейтральных средах с водородной деполяризацией протекает коррозия активных металлов, а в щелочных средах - амфотерных металлов. С кислородной деполяризацией протекает коррозия металлов малой и средней активности в нейтральных средах и в любых средах металлов малой активности, т.е. стоящих в ряду напряжений после водорода. С кислородной деполяризацией протекает атмосферная и почвенная коррозия. Существенное влияние на скорость коррозии оказывает скорость доставки кислорода к металлу путем диффузии или конвекции, а также такие факторы как перемешивание электролита, глубина погружения корродирующего металла, растворимость кислорода в растворе и т.д. Причины возникновения гальванопар.В процессах электрохимической коррозии можно выделить следующие типы возникновения гальванических пар (т.е. разности потенциалов на поверхности металлов): 1. Практически любой металл содержит примеси других металлов или соединения того же металла. В среде электролита система из основного металла и металла примеси образует большое число гальванопар. Участки с более электроотрицательными потенциалами окажутся анодами (по отношению к внутреннему участку цепи) и будут растворяться, a нa более электроположительных участках (катодах) будут происходить процессы восстановления. Таким образом, одной из причин электрохимической коррозии является возникновение микро - и макрогальваничесхих элементов на поверхности металла. На рис. 69 представлена схема коррозии железа с включением меди. Рис.69. Схема коррозии железа с включением меди Электрохимическая система этой гальванопары в электролите изображается, как и в случае гальванического элемента, схемой A (-) Fe│h3SO4│Cu (+) K железо - анод, медь - катод На аноде: Fe - 2ē = Fe2+ На катоде: 2Н+ + 2ē = Н2 В результате железо разрушается в месте контакта, а на меди выделяется водород. 2. Гальванопары могут возникать и в результате неравномерности аэрации, т.е. неравномерного доступа кислорода к различным участкам поверхности металла. На рис. 70 показана схема коррозии железа при неравномерном доступе кислорода. Участки поверхности металла, к которым быстрее диффундирует кислород - катодные, к которым затрудняется доступ кислорода – анодные. На аноде: Fe - 2ē = Fe2+ На катоде: O2 + 2Н2O + 4ē = 4ОН- (в нейтральной среде) Рис. 70. Схема коррозии железа при неравномерной аэрации В ходе коррозии химический состав раствора вблизи металлической поверхности подвергается непрерывным изменениям. Результатом этих изменений являются вторичные реакции. Из приведенной выше схемы видно, что вблизи катодного участка происходит подщелачивание и ионы железа могут вступить в реакцию с ионами OН- с образованием гидроокиси железа: Fe2+ + 2OH- → Fe (OH)2 Труднорастворимая гидроокись железа выпадает в осадок. Если процесс протекает в воздушной среде, то гидроокись железа (II) окисляется кислородом воздуха в гидроокись железа (III): 4Fe (OH)2 + O2 + 2h3O → 4Fe (OH)3 Гидроксиды железа неустойчивы и постепенно могут переходить в соответствующие оксиды. Продукты электрохимической коррозии железа, состоящие из гидратированных оксидов, называются ржавчиной. 3. Возникновение разности потенциалов может наблюдаться для одного и того же металла, части которого контактируют с электролитом разной концентрации. В растворе с меньшей концентрацией поверхность металла заряжается отрицательно (анод), а в более концентрированном растворе - положительно (катод). 4. Часто детали изделия, выполненные из одного и того же металла и различающиеся только по температуре эксплуатации могут подвергаться электрохимической коррозии. Такие контакты встречаются в промышленных устройствах, соприкасающихся с нагретыми газами или жидкостями, например, в паровых котлах, змеевиках и т.д. 5. Различный уровень механических напряжений в одной и той же детали приводит к возникновению микрогальванопар. Если согнутая металлическая пластинка погружена в коррозионную среду, то на растянутом слое через некоторое время начнут возникать трещины (анод), внутренний слой останется без изменения (катод). Факторы, влияющие на коррозию.На скорость коррозии влияют различные факторы: природа металла, его структу- ра и состояние поверхности, химический состав и свойства среды, температура электролита, природа поверхностных оксидных пленок, условия работы изделия, влажность, пыль и др. Например, состав электролита определяет электропроводность и активную концентрацию ионов, участвующих в процессе. Ускоряют коррозионные процессы во всех случаях и для всех металлов ионы Н+, Сl-, Br-, I-, понижая потенциал растворения металлов. Для амфотерных металлов такую роль играют ионы ОН-. Присутствие в электролите ионов или полярных молекул, которые могут выступать как лиганды при комплексообразовании и растворять пассивирующие пленки (Сl -, СN -, Nh4), значительно ускоряет коррозионные процессы. С увеличением температуры скорость коррозии металлов, как правило, возрастает, причем эта зависимость носит экспоненциальный характер. Скорость коррозии стали в НСl, идущая с выделением водорода, удваивается при увеличении температуры на 10°. Однако часто зависимость скорости коррозии от температуры имеет сложный характер (например, в случае, когда процесс коррозии протекает с кислородной деполяризацией). Такое явление наблюдается при коррозии стали в природных водах. 51. Коррозия металлов. Электрохимическая коррозия. Способы защиты. Электрохимическая коррозия металлов это
2.2 Электрохимическая коррозия металлов
2.3Способы защиты от коррозии
2. Электрохимический коррозионный процесс
3. Коррозионные гальванические элементы
51. Коррозия металлов. Электрохимическая коррозия. Способы защиты.
Электрохимическая коррозия
Электрохимическая коррозия — Мегаобучалка
Гальванический элемент
Микрогальванический элемент
Анод-металл с меньшим значением электронного потенциала, катод- с большим.
Перенос электронов проискходит по внешней цепи.
Перенос электронов происходит внутри пластины.
Ионы перемещаются через ключ.
Ионы перемещаются по раствору электролита.
13. Электрохимическая коррозия металлов. Общая характеристика электрохимического коррозионного процесса и явление поляризации. Коррозионный процесс с водородной деполяризацией
Электрохимическая коррозия

Похожие статьи:
poznayka.org










