Строительные работы в Севастополе
Понятие прочности часто связывают с металлами. «Прочный, как сталь», - каждый из нас слышал эту фразу не один раз. На самом деле под химическим воздействием внешней среды металлы могут окисляться и разрушаться. Термин «коррозия» произошёл от латинского "corrodere" – разъедать. Но коррозии подвержены не только металлы. Пластмассы, полимеры, дерево и даже камни также подвержены коррозии. Коррозия – это результат химического воздействия окружающей среды. В результате коррозии металлы разрушаются самопроизвольно. Конечно, разрушаться металлы могут и под влиянием физического воздействия. Такие процессы называют износом, старением, эрозией. Несмотря на то, что в промышленности и в быту широко используются полимеры, керамика, стекло, роль металлов в жизнедеятельности человека продолжает оставаться очень важной. С коррозией металлов мы сталкиваемся очень часто. Ржавое железо – результат коррозии. Нужно сказать, что многие металлы могут подвергаться коррозии. Но ржавеет только железо. Что же происходит с металлами во время коррозии с точки зрения химии? Поверхностный слой металла взаимодействует с кислородом воздуха. В результате образуется оксидная плёнка. На поверхностях разных металлов образуются плёнки разной прочности. Так, алюминий и цинк образуют при взаимодействии с кислородом прочную плёнку, которая препятствует дальнейшей коррозии этих металлов. Защитная плёнка алюминия – оксид алюминия Al2O3. Через неё не могут проникать ни кислород, ни вода. Например, в алюминиевом чайнике кипящая вода не действует на металл. Но некоторые металлы и их соединения образуют рыхлые плёнки. Если отрезать кусочек металлического натрия, то можно увидеть, как на его поверхности появится плёнка, имеющая трещины. Такая плёнка свободно пропустит к поверхности кислород воздуха, пары воды и другие вещества. Коррозия натрия будет продолжаться. Химическая коррозия – это химическое взаимодействие металла и внешней среды, в результате которой происходит реакция окисления металла и восстановления коррозионной среды. Но во внешней среде содержатся не только кислород и пары воды. В воздухе встречаются оксиды азота, серы, углерода, а воде могут быть соли и растворённые газы. И процесс коррозии – довольно сложный процесс. Разные металлы корродируют по-разному. Например, бронза покрывается сульфатом меди (CuOH)2SO4, который похож на зелёную паутину. Коррозия, которая происходит под воздействием электрического тока, не является химической. Её называют электрохимической. Почему же всё-таки железо ржавеет? В процессе коррозии металл окисляется и превращается в оксид. Упрощённое уравнение коррозии железа выглядит так: 4Fe + 3O2 + 2h3О = 2Fe2O3·h3О 2Fe2O3·h3О - гидратированный оксид железа, или гидроксид железа. Это и есть ржавчина. Как видно из уравнения реакции, ржавчина образуется на поверхности железа, если оно взаимодействует с кислородом в воде или во влажном воздухе. В сухом месте железо не ржавеет. Поверхность ржавчины не защищает железо от дальнейшего воздействия среды, поэтому в конце концов железо полностью превратится в ржавчину. Ржавчиной называют коррозию железа и его сплавов. Химическая коррозия бывает газовая и коррозия в жидкостях-неэлектролитах. Газовой коррозией называют процесс разрушения поверхности металла под воздействием газов при высокой температуре. Больше всего известна коррозия при воздействии кислорода на металл. Химическая коррозия металлов и их соединений может происходить в жидкостях-неэлектролитах. Жидкости-неэлектролиты - фенол, бензол, спирты, керосин, нефть, бензин, хлороформ, расплавленная сера, жидкий бром, и другие. Такие жидкости не проводят электрический ток. В чистом виде они не содержат примесей и не реагируют с металлами. Но если в них попадают примеси, то металлы в таких жидкостях начинают подвергаться химической коррозии. Чтобы защитить металлические конструкции от химической коррозии, на поверхность наносят покрытия, которые обеспечат защиту от воздействия коррозионной среды. ximik.biz ЛАБОРАТОРНАЯ РАБОТА №2 «Определение эффективности ингибиторов кислотной коррозии стали» Цель работы: установление оптимальной концентрации ингибитора путем определения скорости коррозии железных и стальных образцов Оборудование: пять химических стаканов на 200 -250 мл., аналитические весы, образцы стали (различные марки), образцы железа-армко Реактивы: 0,25 Н HCl с концентрацией ингибиторов, равной 0,01; 0,1; 0,5; 1,0; 2,0 г/л. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Коррозия – это процесс разрушения металлов вследствие химического, электрохимического или биохимического взаимодействия их с окружающей средой. Коррозия протекает самопроизвольно согласно законам кинетики возможных термодинамических реакций и приводит к понижению свободной энергии металла, в результате чего образуются более устойчивые в термодинамическом отношении соединения. Термин «коррозия» произошел от латинского слова «corrosion» - разъедание. В результате воздействия внешней среды механические свойства металлов резко ухудшаются, иногда даже при отсутствии видимого изменения внешнего вида поверхности. Нередко металлы покрываются продуктами коррозии (ржавеют). Коррозию относят к поверхностным явлениям и классифицируют по тем изменениям, которые происходят с поверхностью металла в результате протекания процесса коррозии. При взаимодействии всей поверхности металла с окружающей средой наблюдается общая, или сплошная, коррозия, а при взаимодействии части поверхности – местная, или локальная. Различают два вида общей коррозии – равномерную и неравномерную. При общей неравномерной коррозии вся поверхность металла покрыта продуктами коррозии, под которыми имеются более глубокие поражения – каверны. К этому же виду коррозии относится и структурно-избирательная коррозия, когда один из компонентов сплава растворяется с большей скоростью, чем другой. В зависимости от механизма коррозионного процесса коррозия бывает химическая, электрохимическая и биохимическая. Одной из важнейших форм коррозии является электрохимическая коррозия - так называемая коррозия металлов, обусловливаемая взаимодействием электрохимического характера. Электрохимическая коррозия бывает нескольких видов: 1. атмосферная коррозия во влажной газовой или воздушной атмосфере; 2. коррозия в жидких средах или коррозия в электролитах, включая коррозию в расплавах солей; 3. почвенная, или подземная, коррозия металлических сооружений, находящихся под землей; 4. электрокоррозия - под действием внешнего источника тока, например коррозия, вызванная блуждающими токами, или коррозия нерастворимых анодов при электролизе. 5. кислотная коррозия Коррозия наносит народному хозяйству огромный, трудно исчисляемый ущерб; полагают, что около 10 % массы ежегодного производства черных металлов расходуется на возмещение потерь металлов от коррозии. Расходы, связанные с изготовлением конструкций, многократно превышают стоимость разрушенного металла. Ремонт сооружений, как правило, исключительно дорогостоящее мероприятие из-за больших затрат труда и применения дорогих дефицитных материалов. Если учесть также расходы, связанные с потерями производства в период репарации, ремонта и аварийных остановок, то становится ясно, что коррозия причиняет неисчислимый ущерб. Виды коррозионных разрушений стали Механизм электрохимической коррозии сводится к следующему. Если в электролит поместить два соприкасающихся различных материала, образуется гальванический элемент, при этом метал, который легче, отдает электроны, служит анодом, а другой - катодом. В процессе работы гальванического элемента анод разрушается. Микрогальванические элементы возникают также между различными фазами сплавов и даже в чистых металлах, где роль анодов играют границы зерен и другие дефектные участки, а роль катода – тело зерна. Чем больше отдельные фазы металла отличаются своими электрохимическими потенциалами, тем быстрее проходит коррозионное разрушение. Существует несколько видов электрохимической коррозии. Если металл однороден, то наблюдается равномерная коррозия, протекающая примерно с одинаковой скоростью по всей поверхности металла. В неоднородном металле, что является наиболее частым случаем, коррозия носит локальный характер и охватывает только некоторые участки поверхности. Эту местную, или локальную, в свою очередь подразделяют на точечную, пятнистую и с язвами. Очаги пятнистой и точечной коррозии являются концентраторами напряжений. Наиболее опасна так называемая интеркристаллитная коррозия, распространяющаяся по границам зерен вследствие более низкого их электрохимического потенциала. Коррозия без заметных внешних признаков быстро развивается по границам зерен, вглубь, резко снижая при этом механические свойства. Сталь, пораженная интеркристаллической коррозией, теряет металлический звук и при изгибе дает надрывы по границам зерен в местах коррозионного разрушения металла. Кроме того, различают коррозию под напряжением, которая возникает при одновременном действии коррозионной среды и напряжений растяжения. Разновидностью этой коррозии является коррозионное растрескивание, т. е. образование в металле тонкой сетки трещин, проходящих по объему зерна при воздействии коррозионной среды и напряжений. Сталь, устойчивую к газовой коррозии при высоких температурах, называют окалиностойкой. Стали, устойчивые к электрохимической, химической, межкристаллитной и другим видам коррозии, называют коррозионно-стойкими (нержавеющими). Повышение устойчивости стали к коррозии достигается введением в нее элементов, образующих на поверхности защитные пленки, прочно связанные с основным металлом и предупреждающие контакт между сталью и наружной агрессивной средой, а также повышающих электрохимический потенциал стали в разных агрессивных средах. Механизм кислотной коррозии железа Ионы металла переходят в раствор на анодных участках в количестве химически эквивалентном реакции, протекающей на катодных участках. На анодных участках идет следующая реакция: Скорость этой реакции в большинстве сред велика, о чем свидетельствует отсутствие поляризации при наложении внешнего анодного тока. Скорость коррозии железа обычно лимитируется катодной реакцией, которая, как правило, значительно медленнее (катодный контроль). В неаэрируемых растворах катодная реакция имеет вид Эта реакция быстро протекает в кислой, но медленно в щелочной или нейтральной водной среде. Например, скорость коррозии железа в деаэрированной воде при комнатной температуре менее 0,005 мм/год. Скорость выделения водорода в этом случае зависит от наличия в металле примесей с низким водородным перенапряжением. На поверхности чистого железа также может выделяться водород, поэтому железо высокой чистоты корродирует в кислотах, но значительно медленнее, чем техническое. Катодная реакция ускоряется в присутствии растворенного кислорода (так называемая реакция деполяризации) Растворенный кислород реагирует с атомами водорода, адсорбированными на поверхности железа. Реакция окисления протекает с той же скоростью, с какой Суммируя (1) и (2) и учитывая реакцию Гидратированный оксид железа FeO*nh3O или гидроксид железа В сильных кислотах, например соляной, серной, диффузионно-барьерная оксидная пленка на поверхности железа растворяется при рН = 4. В более слабых кислотах, например уксусной или угольной, растворение оксида происходит при более высоком рН, поэтому скорость коррозии железа возрастает и начинается выделение водорода при рН = 5 или 6. Это различие объясняется большей общей кислотностью или нейтрализующей способностью частично диссоциированной кислоты по сравнению с полностью диссоциированной кислотой при данном рН. Другими словами, при данном рН в слабой кислоте имеется большее число ионов Возрастание скорости коррозии железа по мере уменьшения рН обусловлено не только увеличением скорости выделения водорода; в действительности облегченный доступ кислорода к поверхности металла вследствие растворения поверхностного оксида усиливает кислородную деполяризацию, что нередко является более важным фактором. В 6 % уксусной кислоте отношение скоростей коррозии в присутствии кислорода и в его отсутствие равно 87. В окисляющих кислотах, например в азотной, действующих как деполяризаторы, для которых скорость коррозии не зависит от концентрации растворенного кислорода, это отношение близко к единице. В общем, чем более разбавлена кислота, тем больше отношение скоростей коррозии в присутствии и в отсутствие кислорода. В концентрированных кислотах скорость выделения водорода так велика, что затрудняется доступ к поверхности металла. Существенное деполяризующее воздействие растворенного кислорода означает, что скорость движения кислоты должна влиять на скорость коррозии. Так и происходит в действительности, особенно в разбавленных кислота. Ингибирующее действие растворенного кислорода проявляется в области критической скорости движения жидкости, которая тем выше, чем интенсивней в начальный период реагирует сталь с кислотой. Движение кислоты относительно металла сносит пузыри водорода и уменьшает толщину инертного слоя жидкости на поверхности металла, что позволяет большему количеству кислорода достичь поверхности. В соответствии с этим, при скорости движения 3,7 м/с сталь в 0,0043 н. stydopedia.ru Cтраница 1 Продукты коррозии железа, образующиеся в серо-водородсодержащих средах, имеют общую формулу Fe Sj / и оказывают существенное влияние на кинетику коррозионного процесса. [1] Продукты коррозии железа, образующиеся в сероводородсо-держащих средах, имеют общую формулу FexSy и оказывают существенное влияние на кинетику коррозионного процесса. [2] Продукты коррозии железа, которое обычно переходит в раствор в виде двухвалентных ионов, при наличии в растворе кислорода воздуха окисляются в гидрат окиси железа. Образующаяся ржавчина состоит из смеси гидратов окиси и закиси железа и имеет переменный состав, который в зависимости от условий образования ржавчины может колебаться. [3] Продукты коррозии железа гигроскопичны, что также влияет на ускорение коррозионного процесса. Гигроскопичными могут быть и продукты коррозии других металлов, что следует учитывать при складском хранении аппаратов, деталей и изделий. [4] Продукты коррозии железа ( ржавчина) имеют различный состав, который зависит от условий протекания коррозии. [5] Продукты коррозии железа ( ржавчина) имеют различный состав, зависящий от условий, в которых протекает коррозия. [6] Продукты коррозии железа ( ржавчина) имеют различный состав, который зависит от условий протекания процесса. [7] Продукты коррозии железа, содержащие кроме этого еще магнетит FeO Fe2O3 и переменное количество аморфных оксидов железа, равномерно распределяются по всей поверхности металла. В отличие от этого на алюминии и его сплавах продукты коррозии образуют отдельные точки, так что местами даже возникают отверстия. При особых условиях коррозия может перфорировать и высоколегированную сталь. Этот вид коррозии очень опасен, так как при относительно небольшом изменении массы и практически невидимых отверстиях ставится под вопрос функциональная способность, например емкостей или трубопроводов. [8] Продукты коррозии железа, которое обычно переходит в раствор в виде двухвалентных ионов, при наличии в растворе кислорода воздуха окисляются в гидрат окиси железа. Образующаяся ржавчина состоит из смеси гидратов окиси и закиси железа и имеет переменный состав, который в зависимости от условий образования ржавчины может колебаться. [9] Поскольку продукты коррозии железа твердые вещества, которые, накапливаясь на поверхности металла, тормозят процесс, последний обычно довольно быстро переходит в диффузионную область. В связи с тем, что при исследовании эрозии в коррозионно-активной среде продукты коррозии будут непрерывно удаляться вследствие эрозионного воздействия потока, несущего абразивные частицы, коррозия может долгое время протекать в кинетической области. Учитывая это обстоятельство, можно считать, что коррозия при эрозионно-коррозионном износе протекает в кинетической области. [10] Ортофосфорная кислота частично растворяет продукты коррозии железа и тем самым облегчает их взаимодействие с комплексообра-зователями. Наряду с органическими комплексами при обработке коррозийных поверхностей происходит постепенное преобразование непрореагировавших продуктов коррозии в магнетит, который также обеспечивает надежную антикоррозийную защиту. Учитывая указанное, в состав грунтов включают такое количество ортофосфорнои кислоты, которое не рассчитано на полное превращение ржавчины в первый период обработки. Избыток ортофосфорнои кислоты, тае связанной с продуктами коррозии, может явиться причиной вторичной подпленочной коррозии. [11] Большое влияние на кинетику углекислотной коррозии оказывают продукты коррозии железа. При взаимодействии железа с угольной кислотой или СО2 может образоваться растворимый в воде бикарбонат железа. Одновременно при этом может образоваться и труднорастворимый карбонат железа FeCO3 ( сидерит), который включается в состав продуктов коррозии железа и благодаря своим экранирующим свойствам снижает его скорость коррозии. В зависимости от соотношения окислов и карбонатов железа ( а при наличии сероводорода - сульфидов железа) защитные свойства карбонатов железа могут проявляться как в форме общей, так и локальной коррозии, что и наблюдается в практике эксплуатации трубопроводов нефтяных месторождений Западной Сибири. [12] Результаты дисперсного анализа проб воды показали, что продукты коррозии железа имеют относительно крупные частицы размером более 0 9 мк, продукты коррозии меди имеют частицы менее 0 25 мк. [13] Вместе с тем в результате электрохимических измерений установлено [87], что продукты коррозии железа ( ржавчина) катодны по отношению к железу и оказывают деполяризующее действие при его коррозии в нейтральных минерализованных электролитах. [14] Страницы: 1 2 3 www.ngpedia.ru Железо и его сплавы с углеродом,, т. е. сталь и чугун, при нормальной температуре и при полном отсутствии влаги не корродируют. Не корродирует железо и в воде, лишенной растворенного кислорода и имеющей нейтральную или щелочную реакцию. При наличии же в окружающей среде кислорода и влаги процесс коррозии железа протекает весьма интенсивно. В условиях почвенной коррозии сталь и чугун обладают примерно равной противокоррозионной стойкостью. Помещенная в грунт стальная труба в первое время более или менее равномерно покрывается оксидной пленкой и ржавчиной (гидратированная окись железа), что можно рассматривать как проявление общей коррозии. Вскоре на поверхности трубы образуются анодные участки, соответствующие нарушениям сплошности оксидной пленки. Здесь происходит активный процесс перехода металла в почвенный раствор, что ведет к возникновению местных видов коррозии (пятна, точечная коррозия и др.). В случае коррозии с кислородной деполяризацией, что имеет место в нейтральных и щелочных почвах, анодные участки образуются на тех частях поверхности трубы, к которым нет доступа кислорода или он более затруднен по сравнению с соседними участками. Одновременно на остальной части поверхности грубы, где имеет место нормальная аэрация, происходят катодные процессы. Картина коррозии железа в почве представляется в следующем виде. В результате анодного растворения ионы железа переходят в почвенный раствор и соединяются с ионами Сl', SO"4, ОН', НСО'з, СО"3. Образовавшиеся соли закиси железа в зависимости от условий коррозии проникают в окружающую почву и рассеиваются или тут же, взаимодействуя с растворенным кислородом и ОН-ионами, превращаются в гидрат окиси железа Fe(OH)3. Поскольку растворимость последнего в нейтральной и щелочной среде невелика, гидрат окиси выпадает в виде геля, образуя бугорки ржавчины. Расстояние, на которое ионы диффундируют от металла в почву, зависит от ряда условий, а именно: от скорости анодного растворения, концентрации почвенного раствора, скорости притока кислорода и т. п. Так, в почвах с невысоким содержанием водорастворимых солей Fe(OH)3 осаждается на анодных участках в виде плотного, хорошо схватывающегося с металлом слоя. При более слабой аэрации и повышенной концентрации солей гидрат окиси может образовывать наросты в виде бугорков ржавчины. www.groont.ru Атмосферная коррозия. Атмосферная коррозия является весьма сложным продуктом, находящимся в постоянном изменении. Поэтому описание последовательности образования различных продуктов коррозии на железе представляет условную схему. Разрушение начинается с окисления железа, т. е. появления положительно заряженной частицы железа – двухвалентного катиона и разложения воды (так как коррозия всегда начинается в присутствии влаги) с образованием гидроксид-иона. При этом получается неустойчивая гидроокись двухвалентного железа, которая затем окисляется до гидроокиси. Гидроокись существует в виде альфа и гамма – модификаций, имеющих равную кристаллическую решётку. При избытке кислорода образуется альфа-модификация, при недостатке кислорода или во влажном воздухе гамма-модификация. Кристаллографически альфа-модификация идентична минералу гетиту, гамма модификация - лепидокрокиту. Обычная рыжая ржавчина в атмосферных условиях состоит из обеих модификаций гидроокиси железа, которая, теряя воду, переходит в окись железа. При определенных условиях процесс идет дальше и на поверхности образуется закись-окись, гндратированный магнетит - соединение железа темного цвета, который после удаления воды переходит в черный стабильный магнетит, очень твердое и чрезвычайно стойкое вещество, почти не взаимодействующее с холодными кислотами и слабо - растворимое в теплых кислотах. Магнетит может защищать поверхность металла, если он образует сплошную пленку. Однако равномерное образование магнетита по всей поверхности происходит чрезвычайно редко из-за неоднородности металла, различной влажности на поверхности, загрязненности и пр. Железо без примесей других элементов в чистом сухом воздухе хорошо сохраняется. Знаменитая железная колонна, сооруженная в 310 году в Дели, до настоящего времени не корродирует. Объясняется это тем, что она сделана из очень чистого железа, например, содержание серы в нем всего 0,006%;.кроме того, окружающий воздух не содержит вредных веществ, а также низкая влажность. Особенно опасна для железа хлорсодержащие соли, образующие хлористое и хлорное железо, которые жадно поглощают воду, давая нестойкие, расплывающиеся соединения. Как правило разрушение идет вглубь металла и имеет вид питтинга. Возможно сквозное поражение металлического предмета. Почвенная коррозия железа. В почве образуются разнообразные продукты коррозии, которые отличаются как по своему внешнему виду и цвету, так и по своим механическим свойствам от продуктов атмосферной коррозии. Наиболее часто встречаются следующие: лимонит - порошкообразная ржавчина желтовато-коричневого цвета; сернокислая соль белого или розового цвета, образующаяся в виде порошка или струпьев; синего цвета вивианит - фосфорнокислая соль, который, залегая плотной пленкой на поверхности предмета, предохраняет его от дальнейшего разрушения; углекислое железо - сидерит и др. Тот или иной вид и состав продуктов коррозии в большой степени зависит от влажности почвы и состава почвенной влаги. При высокой влажности доступ кислорода меньше, и железо меньше подвергается окислению. Объемные изменения при окислении настолько велики, что редко предмет сохраняется целиком. Морская коррозия. Особенностями морской коррозии железных предметов является обрастание кораллами, которое начинается сразу же после попадания предмета в морскую воду. Это подтверждается присутствием ионов кальция во внутренних слоях продуктов коррозии. Слой кораллов затрудняет доступ кислорода к поверхности металла, тем самым создавая анаэробные условия, при которых развивается коррозия под действием сульфовоостанавливающих бактерий. Под слоем кальциевых отложений рН = 8. Коррозия имеет электрохимический характер. Разрушение чугуна происходит по типу "графитизации", анодом является структурная составляющая перлит, катодом - графит. С хлором образуются двух- и трехвалентные соединения железа. Коррозия археологического железа после извлечения его из почвы. Железо особенно чувствительно к изменению внешних условий. После извлечения из почвы состояние предмета резко меняется. Прежде всего, меняется влажность и доступ кислорода к разрушенному металлу, это приводит к резкому увеличению скорости коррозии, затем скорость коррозии несколько уменьшается, но не прекращается. При высыхании металла изменяется состав продуктов коррозии, а следовательно, и их плотность, что способствует появлению микро- и макротрещин. В трещинах находятся красно-коричневые рыхлые продукты коррозии. Рентгенографическим исследованием и ИК-спектроскопией установлено, что эти продукты коррозии представляют собой гидроокись железа, в решетку которой включены ионы хлора. Ионы хлора попадают на предмет из почвенной влаги, которая в зависимости от засоленности почвы содержит то или иное количество хлорсодержащих солей. Концентрация хлоридов в порах предмета может быть больше, чем в окружающем грунте, благодаря их передвижению к металлу в процессе электрохимической коррозии. По определенным причинам, связанным с механизмом коррозии, концентрация хлоридов выше в предметах, у которых частично сохранился металл, чем в полностью окисленных. На красно-коричневом веществе выступают капельки желтоватого раствора, в котором содержатся ионы трехвалентного и двухвалентного железа и хлора, рН раствора меньше единицы. Наличие этих веществ говорит об активном состоянии археологического железа после извлечения его из почвы. При хранении железных археологических находок на воздухе, относительная; влажность которого выше 40%, хлорид двухвалентного железа вступает в реакцию с водой и кислородом воздуха, окисляется до трехвалентного с образованием соляной кислоты. В результате этого в реакцию вступает сохранившийся металл, одновременно увеличивается растворимость продуктов коррозии, например, магнетита. Таким o6pазом быстрее будет разрушаться тот предмет, в котором имеется частично сохранившийся металл. Растворение продуктов коррозии приводит к развитию трещин и ослаблению предмета. Активное разрушение происходит на локальных участках, в которых имеется повышенная концентрация гигроскопичного хлорида. Если первоначальное содержание хлоридов незначительно, то все они могут оказаться связанными с гидроксильными соединениями прежде, чем начнется коррозионный процесс на воздухе. Это приводит к псевдостабильному состоянию. Коррозия в этой случае также развивается, но медленно за счет окисления, например, углекислых и сернистых соединений. При наличии в продуктах коррозии гигроскопичных хлористых соединений разрушение может происходить уже при 20% относительной влажности. В зависимости от сохранности железные археологические предметы могут быть классифицированы следующим образом. 1. Предметы, сохранившие массивное металлическое ядро. Металл прочный, поверхность его покрыта тонким слоем защитных окислов и солей. Форма предмета не искажена. 2. Металлическое ядро сохранилось частично. Предмет покрыт толстым слоем рыхлых, растрескавшихся продуктов коррозии. Форма предмета искажена. 3. Предметы, в которых металлическое ядро отсутствует-. Вся масса металла заменена рыхлыми, бесформенными окислами железа. 4. Рассыпавшиеся на куски полностью минерализованные предметы. Форму, размер предмета установить невозможно. Наличие сохранившегося металла может быть определено радиографией, магнитным способом и по удельному весу. Если удельный вес предмета меньше 2,9, то металл можно считать полностью минерализованным. Наименее стабильны предметы, относящиеся ко второй группе, так как присутствие остатков металла способствует более активному протеканию коррозионного процесса. Первоисточник: art-con.ru При ржавлении металлическое железо окисляется, переходя в состояние окисления + 2, и отслаивается от металла в виде хлопьев, состоящих из РеО или других оксидов железа. Коррозия алюминия протекает еще энергичнее [c.190] Гл. 1. Железо. Коррозия в присутствии кислорода [c.12] Пон нарушении сплошности покрытия луженого железа коррозия будет осу-, 1 л гься в паре железо—олово так же, как и в паре металлов железо—медь поскольку олово, как и медь, менее активный восстановитель, чем [c.692] Применяемый в процессе синтеза 22% раствор гидросульфида натрия содержит около 3 вес.% МагЗ, 4 вес.% ЫагСОз и до 0,4 вес. % хлор-иона. Наиболее интенсивная коррозия углеродистых и низколегированных сталей наблюдается в паровой фазе. На поверхности металла образуется плотный черный слой сульфидов железа. Коррозия стали неравномерная, появляются отдельные раковины и углубления. Срок эксплуатации емкостей для хранения гидросульфида натрия не превышает 8 лет при толщине стенки Ъ мм. Поверхность емкостей, мерников и трубопроводов, проработавших в контакте с гидросульфидом натрия около 60 месяцев, покрывается обильным осадком сульфидов железа, который попадает во всю последующую аппаратуру. Поэтому, если последняя будет выполнена из легированных сталей, то емкости для исходного гидросульфида также должны быть выполнены из более коррозионностойких материалов. Для этой цели целесообразно использовать [c.96] Отдельные точки коррозии только для стали и железа Коррозия до 5% поверхности [c.189] На рис. 17 кривая б зависимости скорости коррозии ряда металлов от рН-среды относится и к поведению железа, коррози-оиная стойкость его резко снижается в электролитах, pH которых скорость коррозии практически не зависит от рН-среды. В щелочных средах коррозия железа [c.81] Коррозионная активность нефтепродуктов существенно возрастает в присутствии микроорганизмов. Коррозия металлов, особенно на основе алюминия, сопровождается образованием осадков, состоящих из воды, смолистых веществ, бактерий -и продуктов их жизнедеятельности. Иногда наблюдается сквозная коррозия. В присутствии окиси железа коррозия еще,более увеличивается, поскольку окись железа в присутствии воды благоприятствует деятельности бактерий. [c.120] Интерес к изучению поверхности кристалла обусловлен многими причинами. Подходя с узко практической точки зрения, можно упомянуть экономическое значение исследований реакции кислорода с поверхностью кристалла железа (коррозия или ржавление), влияния поверхностных слоев на работу различных полупроводниковых приборов и, разумеется, каталитических реакций на кристаллических поверхностях, которые, по-видимому, охватывают все каталитические процессы. [c.112] Внутренние стенки покрыты толстым слоем продуктов коррозии, состоящих в основном из сульфидов железа коррозия неравномерная [c.107] Стенки аппарата покрыты плотным слоем продуктов коррозий, состоящих преимущественно из сульфидов железа коррозия равномерная [c.109] Гл. 1. Железо. Коррозия легированных чугунов [c.148] Появление в воде оксидов железа и меди может быть обусловлено разрушением окалины и оксидных отложений, покрывающих внутренние поверхности оборудования коррозией водоочистительного оборудования под действием исходной и химически обработанной воды коррозией элементов пароводяного тракта использованием на заводах производственного конденсата, содержащего значительное количество оксидов железа коррозией латунных трубок конденсато1ров, охладителей пара эжекторов и выпара деаэраторов и регенеративных подогревателей кислородной коррозией аппаратов и вспомогательного оборудования, находящегося в резерве. [c.137] В химических производствах широкое применение находят трубопроводы, используемые для транспортировки жидких и газообразных продуктов. Наряду с коррозией внутренней поверхности стальных труб может происходить загрязнение транспортируемых продуктов окислами железа. Коррозии подвержена также наружная поверхность труб, часто находящихся под воздействием агрессивных сред или атмосферы. [c.132] По данным" медь и ее сплавы в отсутствие воздуха и других окислителей вполне стойки при нагревании при наличии значительных количеств хлорного железа коррозия резко возрастает В присутствии хлорного железа корродирует В отсутствие хлорного железа при комнатной температуре вполне стоек [c.244] В разбавленных растворах минеральных кислот, имеющих довольно низкое значение pH, в растворах органических кислот и различных композиций с рН=2,0—3,5, обладающих способностью образовывать прочные водорастворимые комплексы с ионами железа, коррозия сталей существенна. Отсутствие надежного ингибирования в этих условиях опасно не только с точки зрения растворения основного металла, но сопряжено с усиленным наводо-роживанием, коррозией напряженных участков, сварных швов. Для комплексообразующих веществ ингибирование позволяет сократить нерациональный расход дефицитных и дорогих реагентов на коррозионный процесс. При использовании ингибиторов в растворах органических кислот скорость коррозии котельных сталей меньше, чем в растворах минеральных кислот с ингибиторами. [c.7] Химия (2001) -- [
c.222
]
Курс общей химии (1964) -- [
c.396
]
Коррозия и защита от коррозии (1966) -- [
c.0
]
Учебник общей химии 1963 (0) -- [
c.405
,
c.406
]
Лекционные опыты и демонстрации по общей и неорганической химии (1976) -- [
c.218
,
c.219
]
Новые проблемы современной электрохимии (1962) -- [
c.287
,
c.289
]
Коррозия химической аппаратуры и коррозионностойкие материалы (1950) -- [
c.0
]
Новые проблемы современной электрохимии (1962) -- [
c.287
,
c.289
]
Лабораторные работы по неорганической химии (1948) -- [
c.234
]
Основы общей химии Том 3 (1970) -- [
c.116
,
c.137
,
c.139
]
chem21.info Атмосферная коррозия. Атмосферная коррозия является весьма сложным продуктом, находящимся в постоянном изменении. Поэтому описание последовательности образования различных продуктов коррозии на железе представляет условную схему. Разрушение начинается с окисления железа, т. е. появления положительно заряженной частицы железа – двухвалентного катиона и разложения воды (так как коррозия всегда начинается в присутствии влаги) с образованием гидроксид-иона. При этом получается неустойчивая гидроокись двухвалентного железа, которая затем окисляется до гидроокиси. Гидроокись существует в виде альфа и гамма – модификаций, имеющих равную кристаллическую решётку. При избытке кислорода образуется альфа-модификация, при недостатке кислорода или во влажном воздухе гамма-модификация. Кристаллографически альфа-модификация идентична минералу гетиту, гамма модификация - лепидокрокиту. Обычная рыжая ржавчина в атмосферных условиях состоит из обеих модификаций гидроокиси железа, которая, теряя воду, переходит в окись железа. При определенных условиях процесс идет дальше и на поверхности образуется закись-окись, гндратированный магнетит - соединение железа темного цвета, который после удаления воды переходит в черный стабильный магнетит, очень твердое и чрезвычайно стойкое вещество, почти не взаимодействующее с холодными кислотами и слабо - растворимое в теплых кислотах. Магнетит может защищать поверхность металла, если он образует сплошную пленку. Однако равномерное образование магнетита по всей поверхности происходит чрезвычайно редко из-за неоднородности металла, различной влажности на поверхности, загрязненности и пр. Железо без примесей других элементов в чистом сухом воздухе хорошо сохраняется. Знаменитая железная колонна, сооруженная в 310 году в Дели, до настоящего времени не корродирует. Объясняется это тем, что она сделана из очень чистого железа, например, содержание серы в нем всего 0,006%;.кроме того, окружающий воздух не содержит вредных веществ, а также низкая влажность. Особенно опасна для железа хлорсодержащие соли, образующие хлористое и хлорное железо, которые жадно поглощают воду, давая нестойкие, расплывающиеся соединения. Как правило разрушение идет вглубь металла и имеет вид питтинга. Возможно сквозное поражение металлического предмета. Почвенная коррозия железа. В почве образуются разнообразные продукты коррозии, которые отличаются как по своему внешнему виду и цвету, так и по своим механическим свойствам от продуктов атмосферной коррозии. Наиболее часто встречаются следующие: лимонит - порошкообразная ржавчина желтовато-коричневого цвета; сернокислая соль белого или розового цвета, образующаяся в виде порошка или струпьев; синего цвета вивианит - фосфорнокислая соль, который, залегая плотной пленкой на поверхности предмета, предохраняет его от дальнейшего разрушения; углекислое железо - сидерит и др. Тот или иной вид и состав продуктов коррозии в большой степени зависит от влажности почвы и состава почвенной влаги. При высокой влажности доступ кислорода меньше, и железо меньше подвергается окислению. Объемные изменения при окислении настолько велики, что редко предмет сохраняется целиком. Морская коррозия. Особенностями морской коррозии железных предметов является обрастание кораллами, которое начинается сразу же после попадания предмета в морскую воду. Это подтверждается присутствием ионов кальция во внутренних слоях продуктов коррозии. Слой кораллов затрудняет доступ кислорода к поверхности металла, тем самым создавая анаэробные условия, при которых развивается коррозия под действием сульфовоостанавливающих бактерий. Под слоем кальциевых отложений рН = 8. Коррозия имеет электрохимический характер. Разрушение чугуна происходит по типу "графитизации", анодом является структурная составляющая перлит, катодом - графит. С хлором образуются двух- и трехвалентные соединения железа.Коррозия археологического железа после извлечения его из почвы. Железо особенно чувствительно к изменению внешних условий. После извлечения из почвы состояние предмета резко меняется. Прежде всего, меняется влажность и доступ кислорода к разрушенному металлу, это приводит к резкому увеличению скорости коррозии, затем скорость коррозии несколько уменьшается, но не прекращается. При высыхании металла изменяется состав продуктов коррозии, а следовательно, и их плотность, что способствует появлению микро- и макротрещин. В трещинах находятся красно-коричневые рыхлые продукты коррозии. Рентгенографическим исследованием и ИК-спектроскопией установлено, что эти продукты коррозии представляют собой гидроокись железа, в решетку которой включены ионы хлора. Ионы хлора попадают на предмет из почвенной влаги, которая в зависимости от засоленности почвы содержит то или иное количество хлорсодержащих солей. Концентрация хлоридов в порах предмета может быть больше, чем в окружающем грунте, благодаря их передвижению к металлу в процессе электрохимической коррозии. По определенным причинам, связанным с механизмом коррозии, концентрация хлоридов выше в предметах, у которых частично сохранился металл, чем в полностью окисленных. На красно-коричневом веществе выступают капельки желтоватого раствора, в котором содержатся ионы трехвалентного и двухвалентного железа и хлора, рН раствора меньше единицы. Наличие этих веществ говорит об активном состоянии археологического железа после извлечения его из почвы.При хранении железных археологических находок на воздухе, относительная; влажность которого выше 40%, хлорид двухвалентного железа вступает в реакцию с водой и кислородом воздуха, окисляется до трехвалентного с образованием соляной кислоты. В результате этого в реакцию вступает сохранившийся металл, одновременно увеличивается растворимость продуктов коррозии, например, магнетита. Таким o6pазом быстрее будет разрушаться тот предмет, в котором имеется частично сохранившийся металл. Растворение продуктов коррозии приводит к развитию трещин и ослаблению предмета. Активное разрушение происходит на локальных участках, в которых имеется повышенная концентрация гигроскопичного хлорида. Если первоначальное содержание хлоридов незначительно, то все они могут оказаться связанными с гидроксильными соединениями прежде, чем начнется коррозионный процесс на воздухе. Это приводит к псевдостабильному состоянию. Коррозия в этой случае также развивается, но медленно за счет окисления, например, углекислых и сернистых соединений. При наличии в продуктах коррозии гигроскопичных хлористых соединений разрушение может происходить уже при 20% относительной влажности. В зависимости от сохранности железные археологические предметы могут быть классифицированы следующим образом.1. Предметы, сохранившие массивное металлическое ядро. Металл прочный, поверхность его покрыта тонким слоем защитных окислов и солей. Форма предмета не искажена.2. Металлическое ядро сохранилось частично. Предмет покрыт толстым слоем рыхлых, растрескавшихся продуктов коррозии. Форма предмета искажена.3. Предметы, в которых металлическое ядро отсутствует-. Вся масса металла заменена рыхлыми, бесформенными окислами железа. 4. Рассыпавшиеся на куски полностью минерализованные предметы. Форму, размер предмета установить невозможно. Наличие сохранившегося металла может быть определено радиографией, магнитным способом и по удельному весу. Если удельный вес предмета меньше 2,9, то металл можно считать полностью минерализованным. Наименее стабильны предметы, относящиеся ко второй группе, так как присутствие остатков металла способствует более активному протеканию коррозионного процесса. Источник: РЕСТАВРАЦИЯ МЕТАЛЛА. Методические рекомендации. ВНИИР. сост. М.С.Шемаханская М., 1989 www.rest-meb.ruМеханизм кислотной коррозии железа. Коррозия железа
Коррозия металла - Популярная химия

Химическая коррозия

Почему железо ржавеет

Виды химических коррозий

Механизм кислотной коррозии железа
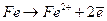 (1)
(1)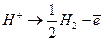 (2)
(2)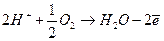 (3)
(3)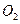 достигает поверхности металла.
достигает поверхности металла.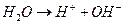 , получаем:
, получаем: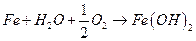 (4)
(4)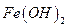 образуют на поверхности железа диффузионно-барьерный слой, через который должен диффундировать кислород. У раствора, насыщенного
образуют на поверхности железа диффузионно-барьерный слой, через который должен диффундировать кислород. У раствора, насыщенного 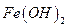 , pH = 9.5 так, что на поверхности железа, корродирующего в аэрированной чистой воде, среда всегда щелочная.
, pH = 9.5 так, что на поверхности железа, корродирующего в аэрированной чистой воде, среда всегда щелочная.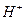 , способных реагировать и растворять барьерную оксидную пленку, чем в сильной кислоте.
, способных реагировать и растворять барьерную оксидную пленку, чем в сильной кислоте.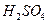 в присутствии кислорода корродирует с такой же скоростью, как и в 5 н.
в присутствии кислорода корродирует с такой же скоростью, как и в 5 н. 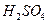 , а в неподвижной кислоте отношение скоростей коррозии около 12.
, а в неподвижной кислоте отношение скоростей коррозии около 12. Продукты - коррозия - железо
Продукты - коррозия - железо
Почвенная коррозия железа
10.2. Коррозия железа | АРТконсервация
Железо коррозия - Справочник химика 21
Гл. 1. Железо. Коррозия железа, чугуна и сталей [c.132]Металл / Коррозия железа