Строительные работы в Севастополе
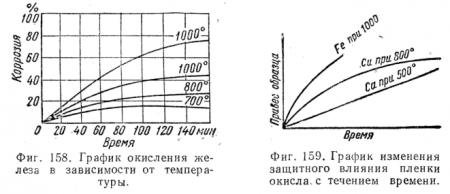
Виды коррозии Химическая коррозия >>>Электрохимическая коррозия >>>Газовая коррозия >>>Атмосферная коррозия >>>Подземная коррозия >>>Биокоррозия >>>Контактная коррозия >>>Радиационная коррозия >>>Коррозионная кавитация >>>Фреттинг-коррозия >>>Межкристаллитная коррозия >>>Щелевая коррозия >>> Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды. По механизму процесса различают химическую и электрохимическую коррозию металлов. Химическая коррозия— это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.Электрохимическая коррозия— это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала. По виду коррозионной среды и условиям протекания различают несколько видов коррозии. Газовая коррозия- это химическая коррозия металлов в газовой среде при минимальном содержании влаги (как правило не более 0,1%) или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто. Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д. Атмосферная коррозия— это коррозия металлов в атмосфере воздуха или любого влажного газа. Подземная коррозия— это коррозия металлов в почвах и грунтах. Биокоррозия— это коррозия, протекающая под влиянием жизнедеятельности микроорганизмов. Контактная коррозия— это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите. Радиационная коррозия- это коррозия, обусловленная действием радиоактивного излучения. Коррозия внешним током и коррозия блуждающим током.В первом случае — это коррозия металла, возникающая под воздействием тока от внешнего источника. Во втором случае — под воздействием блуждающего тока. Коррозия под напряжением— коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений. Если это растягивающие напряжения, то может произойти растрескивание металла. Это очень опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки (оси, рессоры, автоклавы, паровые котлы, турбины и т.д.). Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов. Коррозионная кавитация— разрушение металла, обусловленное одновременным коррозионным и ударным воздействием внешней среды. Фреттинг-коррозия— это коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д. Коррозия называется сплошной, если она охватывает всю поверхность металла. Сплошная коррозия может быть равномерной, если процесс протекает с одинаковой скоростью по всей поверхности металла, и неравномерной когда скорость процесса неодинакова на различных участках поверхности. Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе. Приизбирательной коррозииразрушается одна структурная составляющая или один компонент сплава. В качестве примеров можно привести графитизацию чугуна или обесцинкование латуней. Местная (локальная) коррозияохватывает отдельные участки поверхности металла. Местная коррозия может быть выражена в виде отдельных пятен, не сильно углубленных в толщу металла; язв - разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек (питтингов), глубоко проникающих в металл. Первый вид наблюдается, например, при коррозии латуни в морской воде. Язвенная коррозия отмечена у сталей в грунте, а питтинговая — у аустенитной хромоникелевой стали в морской воде. Подповерхностная коррозияначинается на поверхности, но затем распространяется в глубине металла. Продукты коррозии оказываются сосредоточенными в полостях металла. Этот вид коррозии вызывает вспучивание и расслоение металлических изделий. Межкристаллитная коррозияхарактеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы. Щелевая коррозия вызывает разрушение металла под прокладками, в зазорах, резьбовых креплениях и т.д. studfiles.net Коррозией металла называется его разрушение, вызванное электрохимическим воздействием внешней среды на его поверхность. Разрушение металла труб почвенной коррозией происходит под действием малых электрических токов, возникающих на поверхности металла в результате взаимодействия с ним почвенного электролита. Поверхность металла и электролит образуют гальваническую пару. Та часть поверхности металла, из которой ток переходит в электролит, называется анодом, а та часть, где ток выходит из электролита, - катодом. В анодных зонах металл подвергается разрушению, а в катодных зонах происходит накопление продуктов коррозии без разрушения металла. Подземная электрохимическая коррозия металла, в почвах и грунтах характерна для трубопроводов уложенных в землю, где грунтовые воды являются электролитами. Коррозия блуждающими токами – электрохимическая коррозия металла под воздействием блуждающего тока, подвергаются трубы, уложенные в землю вблизи электрических кабелей и рельсов. В зависимости от типа разрушений коррозии разделяются на сплошную, местную и структурную. Сплошная коррозия охватывает всю поверхность металла. Местная охватывающая отдельные участки с нарушением гладкой поверхности в виде царапин и др. она подразделяется на точечную и сквозную (кровли зданий). Структурная – связанная со структурной неоднородностью металла, подразделяется на межкристаллитную, которая распространяется по границам зерен металла, и избирательную разрушающие структурные составляющие сплава. Так в серых чугунах разрушается металлическая основа, остается лишь скелет из включений графита. Процесс разрушения труб под действием окружающей среды называется коррозией. По характеру взаимодействия металла труб, различают два типа коррозии: химическую и электрохимическую. Химической коррозией называется процесс разрушения всей поверхности металла при его контакте с агрессивным химическим веществом. Электрохимической коррозией называется процесс разрушения металла сопровождающийся образованием и прохождением эл.тока при этом на поверхности металла образуется не сплошное, а местное повреждение металла в виде пятен и раковин. Биокоррозия трубопроводов вызывается жизнедеятельностью микроорганизмов Существует два способа защиты от коррозии: пассивный и активный. Пассивный – изоляционные покрытия различными материалами ( битумно-резиновые и полимерные). Требования к покрытию: водонепроницаемость; прочность сцепления с металлом; хорошая изоляция от эл.тока; достаточная прочность и способность сопротивляться механическим воздействиям при засыпке траншеи. К числу активным способам защиты относится катодная и протекторная защиты. Сущность катодной защиты сводится к созданию отрицательного потеннцала на поверхности трубы. Благодаря чему предотвращается утечка электронов с поверхности трубы, сопровождающаяся ее коррозионным разъеданием. Протекторная защита отличается тем, что необходимый для защиты ток, создается не станцией, а протекторами имеющие более отрицательный потенциал, чем защищаемый объект. Основной металл защищается покрытием лакокрасочным, неметаллическим и металлическим, легированием электрохимическую (пластина цинка, магнитные протекторы. Основан на создании гальванических пар). ЭЛЕКТРИЧЕСКИЕ МЕТОДЫ защиты – катодная, протекторная и дренажная. При катодной – коррозия анодных участков трубы ликвидируется наложением на неё отрицательного потенциала, получаемого от внешнего источника постоянного тока, положительный потенциал которого соединяется с заземленным анодом. При такой схеме происходит разрушение заземленного анода (куска металла) и предотвращается разрушение трубы (катода). При протекторной защите защитный ток возникает в результате работы гальванической пары протектор – труба, причем потенциал протектора должен быть ниже потенциала стали. Здесь не требуется источника электроэнергии, но расходуется значительное количество цветных металлов, поскольку протектор (анод) изготавливают из специальных сплавов – цинка, магния и алюминия. Для повышения эффективности работы протектора его обычно обмазывают смесью глины с гибсовым порошком, что понижает сопротивление анодного заземлителя. Дренажная защита предназначена для отвода блуждающих токов, в зоне прохождения поездов и трамваев, проходящих с газопровода обратно в рельсовую сеть. studfiles.net Все нюансы данного вопроса детально расписаны в ГОСТ № 5272 от 1968 года (Коррозия металлов, термины). Характерной особенностью всех официальных документов является то, что досконально понять их содержание может лишь профильный специалист, с большим практическим опытом. Эта статья дает общее представление о видах коррозии и предназначена тем, кто так или иначе связан с металлообработкой. Одна из разновидностей – газовая. Последняя протекает даже при нормальных температурах, и их повышение только инициирует ускорение процесса разрушения металлов. Характерно для конструкций с заглублением (трубопроводы, свайные фундаменты, металлические опоры). Степень интенсивности зависит в основном от характеристик грунта (например, кислотности), в который помещен металл. Подразумевается полное погружение образца. Причем в данном случае средой является вода. Если речь идет о жидкости, относящейся к категории «электролит», то определены следующие разновидности коррозии в зависимости от степени погружения металла и времени – при неполном, переменном, полном и по ватерлинии. Разрушение металлов происходит из-за влияния микроорганизмов, содержащихся в данной среде. Коррозия, вызванная токами – внешними, блуждающими. Такой вид разрушения металла инициируется в электролитической среде соприкосновением проводников с разными потенциалами. В зависимости от степени поражения образца коррозия классифицируется на следующие разновидности: От любого вида коррозии разработаны методики защиты — подробнее описано здесь. Они выбираются на основе анализа специфики эксплуатации металла и всех сопутствующих этому факторов. ismith.ru Металлы и сплавы могут разрушаться под действием химического (химическая коррозия), электрохимического (электрохимическая коррозия) и механического (эрозия) воздействий внешней среды. Способность металла сопротивляться коррозионному воздействию среды называют коррозионной стойкостью. Коррозия металла или сплава происходит, как правило, на границе раздела фаз, т. е. на границе соприкосновения твердого вещества с газом или жидкостью. Коррозионные процессы подразделяются на следующие виды: по механизму взаимодействия металла со средой; по виду коррозионной среды; по виду коррозионных разрушений поверхности; по объему разрушенного металла; по характеру дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды. По механизму взаимодействия металла со средой различают химическую и электрохимическую коррозию. Коррозию, протекающую под влиянием жизнедеятельности микроорганизмов, относят к биологической коррозии, а протекающую под действием радиоактивного излучения - к радиационной коррозии. По виду коррозионной среды, участвующей в коррозионном разрушении металла или сплава, различают коррозию в жидкостях-неэлектролитах, коррозию в растворах и расплавах электролитов, газовую, атмосферную, подземную (почвенную) коррозию, коррозию блуждающим током и др. По характеру изменения поверхности металла или сплава или по степени изменения их физико-механических свойств, в процессе коррозии независимо от свойств, среды коррозионные разрушения бывают нескольких видов. 1. Если коррозия охватывает всю поверхность металла, то такой вид разрушения называется - сплошной коррозией. К сплошной коррозии относится разрушение металлов и сплавов под действием кислот, щелочей, атмосферы. Сплошная коррозия может быть равномерной, т. е. разрушение металла происходит с одинаковой скоростью по всей поверхности, и неравномерной, когда скорость коррозии на отдельных участках поверхности неодинакова. Примером равномерной коррозии может служить коррозия при взаимодействии меди с азотной, железа - с соляной, цинка - с серной кислотами, алюминия - с растворами щелочей. В этих случаях продукты коррозии не остаются на поверхности металла. Аналогично коррозируют железные трубы на открытом воздухе. Это легко увидеть, если удалить слой ржавчины; под ним обнаруживается шероховатая поверхность металла, равномерно распределенная по всей трубе. 2. Сплавы некоторых металлов подвержены - избирательной коррозии, когда один из элементов или одна из структур сплава разрушается, а остальные практически остаются без изменений. При соприкосновении латуни с серной кислотой происходит компонентно-избирательная коррозия - коррозия цинка, а сплав обогащается медью. Такое разрушение легко заметить, так как происходит покраснение поверхности изделия за счет увеличения концентрации меди в сплаве. При структурно-избирательной коррозии происходит преимущественно разрушение какой-либо одной структуры сплава, так, например, при соприкосновении стали с кислотами феррит разрушается, а карбид железа остается без изменений. Этому виду коррозии особенно подвержены чугуны. 3. При местной коррозии на поверхности металла обнаруживаются поражения в виде отдельных пятен, язв, точек. В зависимости от характера поражений местная коррозия бывает в виде пятен, т. е. поражений, не сильно углубленных в толщу металла; язв - поражений, сильно углубленных в толщу металла; точек, иногда еле заметных глазу, но глубоко проникающих в металл. Коррозия в виде язв и точек очень опасна для таких конструкций, где важно поддерживать условия герметичности и непроницаемости (емкости, аппараты, трубопроводы, применяемые в химической промышленности). 4. Подповерхностная коррозия начинается с поверхности металла в тех случаях, когда защитное покрытие (пленки, оксиды и т. п.) разрушено на отдельных участках. В этом случае разрушение идет преимущественно под покрытием, и продукты коррозии сосредотачиваются внутри металла. Подповерхностная коррозия часто вызывает вспучивание и расслоение металла. Определить ее возможно только под микроскопом. 5. Щелевая коррозия - разрушение металла под прокладками, в зазорах, резьбовых креплениях, в клепаных соединениях и т. п. Она чаще развивается на участке конструкции, находящейся в зазоре (щели). 6. Межкристаллитная коррозия - разрушение металла по границам кристаллитов (зерен) с потерей его механической прочности, внешний вид металла при этом не меняется, но он легко разрушается на отдельные кристаллики под механическим воздействием. Объясняется это образованием между зернами металла или сплава рыхлых, малопрочных продуктов коррозии. Этому виду коррозии подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы. Чтобы избежать межкристаллитной коррозии, в последние годы широко используют нержавеющие стали с пониженным содержанием углерода или в их состав вводят карбидообразователи - титан, тантал, ниобий (в 5-8 - кратном количестве от содержания углерода). При одновременном воздействии на металл или сплав сильно агрессивных сред и механических растягивающих напряжений возможно коррозионное растрескивание, или транскристаллитная коррозия. В этом случае разрушение происходит не только по границам кристаллитов, но разделяется на части сам кристаллит металла. Это очень опасный вид коррозии, особенно для конструкций, несущих механические нагрузки (мосты, оси, тросы, рессоры, автоклавы, паровые котлы, двигатели внутреннего сгорания, водяные и паровые турбины и др.). Коррозионное растрескивание зависит от конструкции аппаратуры, характера агрессивной среды, строения и структуры металла или сплава, температуры и т. д. Например, коррозионное растрескивание углеродистых сталей очень часто происходит в щелочных средах при высоких температурах; нержавеющих сталей - в растворах хлоридов, медного купороса, ортофосфорной кислоты; алюминиевых и магниевых сплавов - под действием морской воды; титана и его сплавов - под действием концентрированной азотной кислоты и растворов йода в метаноле. Следует отметить, что в зависимости от природы металла или сплава и свойств агрессивной среды существует критическое напряжение, выше которого коррозионное растрескивание наблюдается часто. По характеру дополнительных воздействий, которым подвергается металл, одновременно с воздействием агрессивной среды можно выделить коррозию под напряжением, коррозию при трении и кавитационную. 7. Коррозия под напряжением - это коррозия при одновременном воздействии коррозионной среды и постоянных или временных напряжений. Одновременное воздействие циклических растягивающих напряжений и коррозионной среды вызывает коррозионную усталость, т. е. Происходит преждевременное разрушение металла. Этот процесс можно представить следующим образом: сначала на поверхности изделия возникает местная коррозия в виде язв, которые начинают действовать в качестве концентратора напряжений, максимальное значение напряжения будет на дне язв, которое имеет более отрицательный потенциал, чем стенки, в результате чего разрушение металла будет идти вглубь, а язва будет переходить в трещину. Этому виду коррозии подвержены валы гребных винтов. Рессоры автомобилей, канаты, охлаждаемые валки прокатных станов и др. 8. Коррозия при трении - разрушение металла, вызываемое одновременным воздействием коррозионной среды и трения. При колебательном перемещении двух поверхностей относительно друг друга в условиях воздействия коррозионной среды происходит коррозия истиранием, или фреттинг-коррозия. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д. 9. Газовая коррозия - это химическая коррозия металлов в газовой среде при минимальном содержании влаги (как правило не более 0,1%) или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто. Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д. 10. Атмосферная коррозия - это коррозия металлов в атмосфере воздуха или любого влажного газа. 11. Подземная коррозия - это коррозия металлов в почвах и грунтах. 12. Контактная коррозия - это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите. www.uralpsk.ru ПОНЯТИЕ О КОРРОЗИИ МЕТАЛЛОВ Коррозией называется разрушение металла под химическим действием окружающей среды. Металлы встречаются в природе преимущественно в виде соединений с неметаллическими элементами, например, железо — в виде Fe2О3 и др., алюминий — А12О3, медь — Cu2S и т. д. Для получения металла в чистом виде необходима затрата энергии, так как металлургическими процессами нарушается равновесное состояние между металлом и веществами, с которыми он связан в естественном состоянии. Полученные в результате металлургических процессов металлы под действием атмосферных условий (газов и влаги) снова стремятся перейти в устойчивые соединения с другими веществами, иначе говоря, корродируют. В настоящее время коррозия выводит из строя ежегодно около 1 % находящегося в пользовании металла. В изделиях и сооружениях в результате коррозии может происходить последовательное разрушение поверхности, образование раковин и приобретение металлом губчатого строения. Разработка современной теории коррозии основана на исследованиях Г. В. Акимова, Н. А. Изгарышева, Н. Д. Томашева и др. ВИДЫ КОРРОЗИИ Различают два основных вида коррозии металла: химическую и электрохимическую. Химической коррозией называются процессы разрушения металла в сухих газах или в жидкостях, не проводящих электрического тока (масло, бензин). Такого рода коррозия имеет, например, место при окислении металла в термических печах, при разъедании топочных связей и пр. Степень химической коррозии сильно возрастает с повышением температуры; в виде примера можно указать на цвета побежалости. Скорость разрушения металла при химической коррозии определяется степенью сродства металла с кислородом и свойствами образующейся при этом пленки (ее плотностью, отсутствием в ней пор, прочностью прикрепления пленки к металлу). На фиг. 158 приведен график окисления железа в зависимости от температуры. Опыт показывает, что пленка окисла обнаруживает защитные свойства, если объем окисла больше объема окисленного металла; так, для Са, Сu и Fe отношение объема окисла к объему окисленного металла соответственно равно 0,78; 1,70 и 2,06. Защитные свойства пленки окислов меди и железа можно видеть на фиг. 159; из графика видно, что для Са пленка не обнаруживает защитных свойств. Переменный нагрев и охлаждение металла увеличивают скорость коррозии, так как колебания температуры нарушают цельность пленки. Химическая коррозия может разрушать металл не только с поверхности, но и между кристаллическими зернами, проникая в глубь металла. В последнем случае коррозия называется межкристаллитной. Электрохимической коррозией называется разрушение металла при соприкосновении с жидкостями, проводящими электрический ток. Происходящие здесь явления аналогичны тем, которые имеют место в гальваническом элементе. Металлическая пластинка, погруженная в жидкость, проводящую ток, выделяет частицы, заряженные положительно, — ионы, а сама заряжается отрицательно — электронами. Между пластинкой и жидкостью устанавливается электростатическое равновесие. Количество ионов, выделяемое различными металлами, различно, следовательно, различны и их потенциалы. При соединении погруженных в жидкость пластинок из разнородных металлов проводником, находящимся вне жидкости, по последнему потечет ток (фиг. 160) электронов от А к В; одновременно и в жидкости возникает ток ионов от А к В. На поверхности пластинки В ионы нейтрализуются электронами, притекшими по проводнику. Включенный в цепь гальванометр покажет течение электричества в цепи. В результате происходит разрушение пластинки А (анода). В гальванической паре разрушается тот металл, который выделяет большее количество положительно заряженных ионов и, следовательно, сам получает более высокий отрицательный заряд. Для сравнения электроположительных свойств металлов их электродные потенциалы измеряются в одинаковых условиях по отношению к потенциалу водородного электрода, принятому равным нулю. По мере убывания положительного заряда в паре с водородным электродом пли, как принято говорить, по мере убывания электроположительных свойств, металлы располагаются в ряд, называемый рядом напряжений: Au, Pt, Hg, Ag, Сu, Bi, Sb, (h3), Pb, Sn, Ni, Co, Cd, Fe, Cr, Zn, Mn, Al, Mg, Be, Na, K. Li. Этот ряд составлен при условии, что определение электродных потенциалов производилось при нормальной концентрации раствора (в растворе, содержащем 1 г-эквивалент ионов данного металла на 1 л при 18° С). Всякий металл, занимающий в этом ряду более правое положение, будет разрушаться в контакте с занимающими более левое положение и тем сильнее, чем дальше эти металлы находятся друг от друга в ряду. В зависимости от электролита порядок расположения указанных металлов в ряде напряжений может быть и другой, а следовательно, может измениться и относительная способность к корродированию. Скорость разъедания характеризуется силой тока между ними. Величина этого тока может уменьшаться и коррозия замедляется, вследствие поляризации электродов и, в первую очередь, катода, на котором в процессе коррозии накапливаются электроны. Деполяризация катода (удаление электронов) может происходить двумя путями: а) путем выделения водорода на катоде с поглощением при этом электронов; такой процесс деполяризации имеет место в кислой среде; б) путем снятия с катода электронов газообразным кислородом, находящимся в растворе с образованием при этом гидроксил-ионов по уравнению такого вида деполяризация характерна для нейтральных растворов. Поляризация уменьшает электродвижущую силу пары и способна даже изменить знак потенциала. Поэтому интенсивность процесса разрушения металла при электрохимической коррозии зависит также и от степени поляризации электродов: чем больше поляризация, тем слабее коррозия и наоборот. Различают следующие виды электрохимической коррозии: гальванокоррозйю и коррозию под влиянием блуждающих токов. Гальваиокоррозией называется процесс разрушения металла при соприкосновении разнородных металлов в присутствии электролита; в качестве примера можно указать на разрушение железа паровых котлов, образующих гальваническую пару с топочной медью. Во многих случаях процесс гальванокоррозии обусловливается неоднородностью структуры металла или сплава. В качестве примера можно указать на разрушение перлита; здесь отрицательно заряженным является феррит (по отношению к цементиту), подвергающийся разрушению в присутствии влаги. Коррозию, возникающую в результате неоднородности структуры, т. е. вследствие наличия микроэлементов, называют микрокоррозией или структурной коррозией. Распространенное мнение, что микрокоррозии подвергаются только сплавы, нельзя считать вполне правильным, так как неоднородность структуры может иметь место и в чистом металле, например, вследствие наклепа. Кроме того, некоторая возможность микрокоррозии чистого металла может вызываться неодинаковостью потенциалов в различных точках поверхности металла, которая никогда не бывает абсолютно однородной. Однако очевидно, что чистые металлы могут подвергаться микрокоррозии в меньшей мере по сравнению со сложным по структуре сплавом и что микрокоррозия проявляется тем меньше, чем меньше неоднородность поверхности металла. Вызывающие микрокоррозию токи весьма малы: величина их может быть равна приблизительно 10-6—10-7 а/см2. Малая величина этих токов компенсируется продолжительностью их действия. В районах, обслуживаемых электрическими железными дорогами, токи, возвращающиеся из сети на станцию через рельсы, могут частично ответвляться, проходя по металлу предметов, находящихся в почве (водопроводных труб, каркасов железобетонных сооружений и пр.). В этом случае почва, содержащая растворы солей, играет роль электролита; разрушению подвергается металл, являющийся анодом. Такой вид коррозии называют коррозией под влиянием блуждающих токов. Факторы, влияющие на скорость коррозии Внутренние факторы. К внутренним факторам, влияющим на скорость коррозии, относятся химический состав, структура, внутренние напряжения и состояние поверхности металла. Чистые металлы при прочих равных условиях менее подвержены коррозии, чем сплавы. Менее других подвержены коррозии сплавы, имеющие структуру твердого раствора. Внутренние напряжения материала способствуют коррозии его; наклепанный материал разъедается больше, чем материал с нормальной структурой. Наличие внутренних напряжений и наклеп способствуют образованию гальванопар. Чем ровнее поверхность металла, тем меньше он корродирует; при повреждении поверхности металл начинает корродировать быстрее. Причиной этого является то обстоятельство, что гладкая поверхность лучше покрывается защитной пленкой. Внешние факторы. К внешним факторам, влияющим на скорость коррозии, относятся действие на металл окружающей среды: воды, кислот, щелочей, солей и газов, а также температура окружающей среды. Коррозионная усталость металла Коррозионной усталостью металла называется разрушение металла, находящегося под одновременным воздействием циклических напряжений и факторов, вызывающих коррозию. Причиной быстрого разрушения металла является, с одной стороны, разрушение пленки окисла и, следовательно, неиспользование ее защитных свойств, а с другой — поверхностное разрушение металла, вызываемое коррозией, способствующее возникновению трещин усталости. Под влиянием коррозии предел усталости металла снижается в некоторых случаях на 65% против нормальной величины. Скачать реферат: У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ Пароль на архив: privetstudent.com privetstudent.com Почти во всяком сплаве имеет место гальваническая коррозия, так как сплавы неоднородны по химическому составу и представляют собой совокупность твердого раствора, структурных образований, составляющих эвтектики, химических соединений. Эти составляющие имеют разные электродные потенциалы. При соприкосновении сплавов с электролитом одни участки сплава будут анодами и начнут разрушаться, а участки, являющиеся катодами, сохраняются неизменными (рис. 4). Так как таких анодных и катодных участков в сплаве очень много, то сплав можно рассматривать состоящим из большого числа электродов, т. е. как многоэлектродный микроэлемент. Рис. 4. Коррозия сплавов:а - поверхность до коррозии, б - после коррозии Такое явление называется микрогальванической коррозией. Из сплава в раствор извлекается более активный компонент. Вследствие этого поверхность его обогащается более благородным металлом. Такая коррозия называется избирательной или селективной. Иногда компоненты сплава переходят в раствор в тех же пропорциях, в каких они содержатся в сплаве. В результате реакций в растворе менее активный компонент может появляться обратно на твердой поверхности, и в этом случае избирательная коррозия кажущаяся.Металлы и сплавы могут растворяться одновременно как по механизму электрохимической, так и химической коррозии. Соотношение между скоростями этих типов разрушения меняется в зависимости от условия: электродных потенциалов, состава раствору температуры, движения среды. В последнем случае облегчается доступ коррозионных агентов к поверхности удаление с нее продуктов коррозии. Большинство видов коррозии — электрохимические. Коррозионное растрескивание напряженных металлов также имеет электрохимическую - природу. Состояние металла по отношению к действию определенной среды может быть активное и пассивное. Пассивированным называется такое состояние металла, при котором он не корродирует в данной среде. Если железо опустить в концентрированную азотную кислоту, то на его поверхности образуется очень тонкий, но плотный слой окиси и наблюдается пассивирование. В таком состоянии железо не растворяется ни в концентрированной, ни в разбавленной азотной кислоте. Изучение пассивного состояния и разработка его теории помогли создать в СССР впервые в мире метод анодной защиты металлов и сплавов. Первые успехи связаны с работами Я. М. Колотыркина, Н. Д. Томашова, И. В. Розенфельда и других исследователей. Всякое воздействие, способствующее снятию с металла защитной пленки или ее разрыхлению, усиливает коррозию. Одним из наиболее энергичных стимуляторов последней является ион хлора, действием которого обусловлено особенно быстрое разрушение большинства металлов морской водой. Более высокое содержание солей, и следовательно, более высокая электропроводность среды усиливают ее агрессивность. Нельзя говорить о стойкости того или иного металла и сплава без учета среды. Ведь даже такой коррозионно-устойчивый металл, как золото, по существу корродирует в "царской водке" - смеси соляной и азотной кислот (3 : 1). Углерод в железоуглеродистых сталях ускоряет коррозию в кислоте, в нейтральных растворах повышает скорость коррозии, а в некоторых окислительных средах он увеличивает стойкость изделий. Структура сплавов имеет непосредственное отношение к их коррозионному поведению. Гомогенные сплавы более стойки, чем гетерогенные при равных условиях. Показано, что накопление карбидов (FеСr)26С6 или ТіС на поверхности сталей ведет к самопассивации. Однако если при каких-либо условиях начинается избирательная коррозия, то эти соединения могут представлять большую опасность. Например, в окислительных средах сталь, легированная титаном, обладает относительно низкой коррозионной стойкостью из-за возможного избирательного растворения ТіС. Получение подобных данных позволяет давать рекомендации по использованию сплавов Карбиды ТіС и Mo2C могут быть рекомендованы для придания коррозионной устойчивости изделиям в восстановительной среде. В окислительных же средах самые известные карбиды образуют следующий ряд по мере повышения устойчивости: Это важно для практических целей, так как (в зависимости от условий работы металлической конструкции) помогает подобрать материал для ее сооружения. www.paxildefects.net Коррозией называется непроизвольное разрушение металлов и сплавов под действием окружающей среды. Коррозия называется химической, если она происходит под действием сухих газов или жидкостей-неэлектролитов, т.е. жидкостей, не проводящих электрический ток (бензин, керосин, смола и т.п.). Коррозия называется электрохимической, если она происходит при взаимодействии с жидкостями-электролитами, т.е. проводящими электрический ток (вода, пар, водяные растворы солей, щелочи, кислоты и т.п.). Так как в подавляющем большинстве случаев металлические детали работают в условиях влажной атмосферы или газов, а некоторые детали, например в подводных лодках, пароходах и гидросамолетах, при непосредственном контакте с растворами солей (морская вода), то явление коррозии может наблюдаться на них в сильной степени, если не будут приняты меры, замедляющие скорость коррозии или устраняющие ее вовсе. Статистические данные показывают, что количество металлов и сплавов, пришедших в негодность от коррозии, составляет около 40% от общего количества выплавленных металлов и сплавов. Мировые потери от коррозии за время с 1890 по 1923 г. выражаются огромной цифрой — 706 млн. т из 1760 млн. т общего количества чугуна и стали, выплавленных за тот же период. При химической коррозии металл или сплав, взаимодействуя с газами при высоких температурах или с жидкостями-неэлектролитами. образует различные химические соединения (оксиды, сульфиды и др.), т. е. разрешается, переходя в неметаллическое состояние. При электрохимической коррозии металл или сплав, взаимодействуя с электролитом, переходит в раствор в виде положительно заряженных частиц (ионов). Происходящие здесь процессы напоминают действие простейшего гальванического элемента. Если такой элемент состоит из пластинки цинка, опущенной в раствор сернокислого цинка, и пластинки меди, опущенной в раствор сернокислой меди, то при замыкании этих пластинок возникает электрический ток и электроны начинают перемещаться от цинковой пластинки к медной. Это значит, что у цинка большая способность превращаться в положительно заряженные частицы (ионы). В силу этих причин цинковая пластинка в гальваническом элементе в процессе работы будет разрушаться. Образование микрогальванических элементов вследствие неоднородности структуры при взаимодействии металлов и сплавов с жидкостями-электролитами и составляет сущность процесса электрохимической коррозии. § www.conatem.ruКоррозия металлов, виды коррозии. Виды коррозии металлов и сплавов
Виды Коррозии
Коррозия металлов, виды коррозии.
Способы защиты металлических изделий от коррозии.
Основные виды коррозии металлов - химические и электрохимические
Атмосферная

Подземная

Подводная

Биологическая


Контактная коррозия

Виды коррозии металла в Челябинске



Понятие о коррозии металлов » Привет Студент!


Особенности коррозии сплавов




Коррозия металлов
Химическая коррозия металлов и сплавов
Электрохимическая коррозия металлов и сплавов





